
题目列表(包括答案和解析)
27、(8分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为: 。
(2)W与Y可形成化合物W2Y,该化合物的水溶液PH=8,则C(HY-)+2C(H2Y)= _______ _____
(3)将Y的低价氧化物通入W的最高价氧化物对应水化物中,经充分反应后,所得溶液呈中性,则混合溶液中的溶质主要为 ;
溶液中C(W+)= + 。
26.(10分)
(1)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则醋酸体积 氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,溶液中
c(Na+) c(CH3COO-) (填“ >” 或“=”或“<”)。
(3)某温度(t℃)时,水的KW =10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=___ ______;
若所得混合溶液pH=2,则a:b=_____ _____。
(4)室温下,若某pH值的硫酸溶液中水电离出的c(H+)=1.0×10-amol·L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-bmol·L-1,(已知a,b均为小于14的正整数),那么a和b之间满足的数量关系是_________ _________。(用一个等式和一个不等式表示)。
25.(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气) C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(2)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
(3)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较正确的是 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
24.(10分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如
 下几步:
下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.0mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。 请回答:
(1)以上步骤有错误的是(填编号)___ __,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________ ________
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色
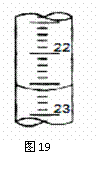
(3)图19是某次滴定时的滴定管中的液面,其读数为 mL
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L
|
滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.40 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.00 |
|
第二次 |
20.00 |
2.00 |
24.10 |
23.(8分)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
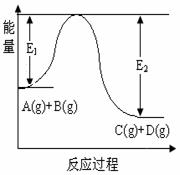
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________
(填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”“减小”“不变”)。
(4)已知下列热化学方程式:
①H2(g) +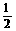 O2
(g) =H2O(l);ΔH=-285 kJ·mol-1
O2
(g) =H2O(l);ΔH=-285 kJ·mol-1
②H2(g) +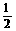 O2
(g) =H2O(g);ΔH=-241.8 kJ·mol-1
O2
(g) =H2O(g);ΔH=-241.8 kJ·mol-1
③C(s) +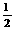 O2
(g) =CO(g);ΔH=-110.5 kJ·mol-1
O2
(g) =CO(g);ΔH=-110.5 kJ·mol-1
④ C(s) +O2 (g) =CO2(g);ΔH=-393.5 kJ·mol-1
回答下列问题:
① 燃烧1gH2生成液态水,放出的热量为 。
②写出CO燃烧热的热化学方程式 。
22、 (共12分)I.现有下列电解质溶液:① Na 2CO3 ② NaHCO3 ③
(共12分)I.现有下列电解质溶液:① Na 2CO3 ② NaHCO3 ③  -ONa ④CH3COONH4 ⑤NH4HCO3 已知酸性H2CO3
> -OH > HCO3-
-ONa ④CH3COONH4 ⑤NH4HCO3 已知酸性H2CO3
> -OH > HCO3-
(1)常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为(填写序号):
> > 。
(2)写出⑤与足量NaOH溶液混合加热反应的离子方程式 。
(3)已知常温下CH3COONH4 溶液呈中性,根据这一事实推测⑤溶液的pH 7(填>、=或<)
II、(1)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为_____ _____。
(2)将标准状况下的4.48 L氨气完全溶解在含0.1 mol HCl的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是 。
(3)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性, AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表示为__________________________。
21.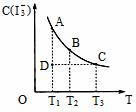 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,
I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,
I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是:( )
A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
卷Ⅱ(非选择题,共60分)
20.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01mol•L-1的NaOH溶液 B.加入10mL 的水进行稀释
C.加水稀释成100mL D.加入10mL 0.01mol•L-1的盐酸溶液
19.关于浓度均为0.1 mol/L的三种溶液: ①氨水、②盐酸、③氯化铵溶液,下列说法
不正确的是( )
 A. c(NH
A. c(NH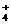 ):③>①
):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)<c(OH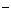 )+c(NH3·H2O)
)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH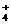 )>c(Cl
)>c(Cl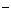 )>c(OH
)>c(OH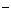 )>c(H+)
)>c(H+)
18.物质的量浓度都为1mol/L的盐酸和醋酸各100 mL,分别加入5g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A. 醋酸与锌反应放出氢气多 B. 盐酸和醋酸分别与锌反应放出的氢气一样多
C. 醋酸与锌反应速率慢 D. 盐酸和醋酸分别与锌反应的速率一样大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com