
题目列表(包括答案和解析)
2.将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应:
NH4Br(s)  NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)  Br2(g)+H2(g)
Br2(g)+H2(g)
2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用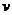 (NH3)表示,下列反应速率正确的是
(NH3)表示,下列反应速率正确的是
A.0.5mol/(L·min) B.2.5 mol/(L·min)
C.2 mol/(L·min) D.5 mol/(L·min)
1.下列溶液中,不需要避光保存的是
A.硝酸银溶液 B.浓盐酸 C.浓硝酸 D.氯水
21. 能 不变 小于 BCD
20. 0.1 80 bd 80%
19.向左,加深, 不 不改变 -77.6
17 2Fe-4e-=2Fe2+ O2+4e-+2H2O=4OH-
C; 负
18. 2H+ + 2e- = H2 溶液变红 2.24
用湿润的淀粉碘化钾试纸靠近Y极开口处,试纸变蓝,说明有CI2生成。
2NaCl + 2H2O === 2NaOH + Cl2 + H2
CuSO4 Fe Cu - 2 e- == Cu 2+ 25.6
1~16 B C A D A A D A D A A B B D C C
21.(8分)德国人哈伯在1905年发明的合成氨,其反应原理为:N2(g)+3H2(g) 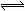 2NH3(g)
2NH3(g)
已知298K时:正反应的△H= -92.4KJ/mol, △S= -198.2J/mol/K.试回答下列问题:
(1)根据正反应的焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(2)加压平衡向正反应方向移动,该反应平衡常数K
(填“变”或“不变”),当浓度商(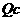 )
化学平衡常数(Kc)(填“大于”、“等于”、“小于”)时,反应向右进行。
)
化学平衡常数(Kc)(填“大于”、“等于”、“小于”)时,反应向右进行。
(3)在实际工业合成氨生产中采取的措施是 (填序号)。
A采用较低压强
B采用700K左右的高温
C用铁触媒作催化剂
D将生成的氨液化并及时分离出来,未反应的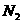 和
和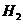 重新循环到合成塔中
重新循环到合成塔中
答案及说明
20. (8分)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)
(8分)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g) H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。
(1) 0-2 min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
(2) 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(l) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
19.(10分)
 (1)已知可逆反应2NO2(g)
(1)已知可逆反应2NO2(g) 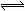 N2O4(g) ΔH<0 ,在一定条件下已经达到平衡。
N2O4(g) ΔH<0 ,在一定条件下已经达到平衡。
若恒容条件下升温,平衡 移动(填“向左”“向右”或“不”);若只缩小体积气体颜色将_________(填“加深”、“变浅”或“不变”);若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
 (2)O2 (g)=
O+2(g)+e-
(2)O2 (g)=
O+2(g)+e- 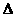 H1=
1175.7 kJ·mol-1
H1=
1175.7 kJ·mol-1
 PtF6(g)+ e-1
PtF6(g)+ e-1 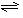 PtF6-(g)
PtF6-(g) 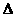 H2=
- 771.1 kJ·mol-1
H2=
- 771.1 kJ·mol-1
 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2
kJ·mol-1
H3=482.2
kJ·mol-1
 则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的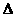 H=_____________
kJ·mol-1。
H=_____________
kJ·mol-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com