
题目列表(包括答案和解析)
5. 实验室制取下列气体时,与实验室制氨气的气体发生装置相同的是
A.H2 B.O2 C.Cl2 A.CO2
4. 下列物质中酸性最强的是
A.H3PO4 B.HNO3 C.H2CO3 D.H3BO3
3. 在NO2与水的反应中,NO2
A. 只是氧化剂
B. 只是还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
2. 下列气体,不能用排空气法收集的是
A.CO2 B.H2 C. NO2 D. NO
1. 下列气体中,不会造成空气污染的是
A.N2 B. NO C.NO2 D.CO
18.(18分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(1)
=2NH3(g)+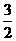 O2(g)
ΔH=+765.2kJ·mol-1
O2(g)
ΔH=+765.2kJ·mol-1
回答下列问题:
(1)请在答题卡的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议 。
(3)工业合成氨的反应为N2(g)+3H2(g) 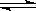 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为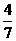 。计算:①该条件下N2的平衡转化率;②该条件下反应2NH3(g)
。计算:①该条件下N2的平衡转化率;②该条件下反应2NH3(g) 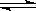 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
17.(8分)在2L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol/L,当反应到8min时,反应到达平衡,
c (O2)=c(SO2),
(1)此时三氧化硫浓度为多少?(请写出计算过程)
(2)在答题卷的坐标系中作出0min-8min及之后SO2、O2、SO3浓度随时间变化曲线。
16.(12分)人体中的血红蛋白(简写为Hb)可以携带氧气变为氧合血红蛋白(简写为HbO2)。其化学平衡方程式可写为:Hb + O2  HbO2。在海拔比较高的地方,氧气的浓度比较低,平衡将向左移动,人体会感到比较累并易有眩晕感,严重时还会导致疾病。CO可与HbO2反应生成HbCO,并且HbCO比HbO2要稳定得多,其化学平衡方程式可写为:
HbO2。在海拔比较高的地方,氧气的浓度比较低,平衡将向左移动,人体会感到比较累并易有眩晕感,严重时还会导致疾病。CO可与HbO2反应生成HbCO,并且HbCO比HbO2要稳定得多,其化学平衡方程式可写为:
HbO2+CO  HbCO+O2 Kc=
HbCO+O2 Kc=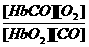 =2.1×102 (注:[O2]代表O2浓度,其它同样)
=2.1×102 (注:[O2]代表O2浓度,其它同样)
(1)HbCO的形成使得血红蛋白不再携带氧气而造成人员中毒。-旦发生CO中毒,首要做的事是让患者呼吸新鲜的空气。试从化学平衡的角度分析这样做的意义。______ _____ _____________________________________________________________________。
(2)除了CO和O2,HbO2还可以吸附CO2和氢离子,且反应几乎是完全的。方程式如下:
HbO2 + H+ + CO2 Hb(H+)CO2 + O2 人体在肌肉剧烈运动时会产生乳酸[ CH3CH(OH)COOH ] [乳酸电离方程式为: CH3CH(OH)COOH
Hb(H+)CO2 + O2 人体在肌肉剧烈运动时会产生乳酸[ CH3CH(OH)COOH ] [乳酸电离方程式为: CH3CH(OH)COOH CH3CH(OH)COO-+ H+],请写出乳酸在血液中和氧合血红蛋白发生反应的离子方程式
。
CH3CH(OH)COO-+ H+],请写出乳酸在血液中和氧合血红蛋白发生反应的离子方程式
。
(3)肌肉剧烈运动时放出大量的热量,氧合血红蛋白会放出更多氧气,你认为乳酸和氧合血红蛋白的反应是吸热反应还是放热反应? ;简述理由 。
15.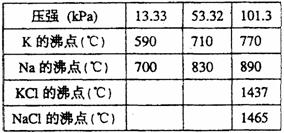 (13分)钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
(13分)钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l)
NaCl(l)+K(g);DH >0,
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见右表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为___________,而反应的最高温度应低于_______________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是①_______;②_______;③_______。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K=____________。
14.(6分)已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
Fe2O3(s)+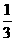 CO(g)=
CO(g)=
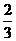 Fe3O4(s)+
Fe3O4(s)+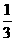 CO2(g) △H=-15.73kJ/mol
CO2(g) △H=-15.73kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式(要求写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com