
题目列表(包括答案和解析)
15、 有一可逆反应2A(g)+3B(g) xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应
有一可逆反应2A(g)+3B(g) xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应
(1)0.8molA、1.2molB、1.2molC、2.4molD
(2)1.4molA、2.1molB、0.6molC、1.2molD
达到平衡后,C的质量分数相等,则方程式中x值为:
A 1 B 2 C 1或2 D 不能确定
14、下列说法正确的是:
A pH<7的溶液一定是酸溶液
B pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍
C 室温下,每1×107个水分子中只有1个水分子发生电离
D室温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,则该溶液一定是酸性溶液
13、常温时,pH=1的两种一元酸溶液HA和HB,分别加水稀释1000倍,两溶液的pH值与所加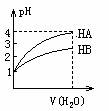 水的体积变化如图所示,下列结论中正确的是:
水的体积变化如图所示,下列结论中正确的是:
A 在稀释过程中HA与HB溶液中c(OH-)均增大
B 当稀释100倍时,HB的pH为3
C 在稀释过程中当两者pH分别都是2时,c(HA)>c(HB)
D 等物质的量浓度的HA和HB,其酸性HA<HB
12、醋酸的下列性质中,可以证明它是弱电解质的是:
A醋酸溶液可与纯碱溶液反应产生CO2
B相同pH的醋酸溶液和盐酸分别跟同样大小颗粒的锌反应时,产生H2的起始速率相等
C10 mL 1 mol·L-1醋酸溶液恰好与10 mL 1 mol·L-1NaOH溶液完全反应
D在相同条件下,醋酸溶液的导电性比盐酸溶液的弱
11、使两种气体X2、Y2(浓度均为1 mol/L)在密闭容器中反应生成Z,平衡后测得各物质的浓度是:c(X2)=0.58 mol/L,c(Y2)=0.16 mol/L,c(Z)=0.84 mol/L,则Z的化学式是:
A XY B X2Y C XY2 D X3Y2
10、已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是:
A H2O(g)=H2(g)+1/2O2(g) △H=+242kJ/mol
B 2H2(g)+O2(g)=2 H2O(l) △H=-484kJ/mol
C H2(g)+1/2O2(g)=2 H2O(g) △H=+242kJ/mol
D 2H2(g)+O2(g)=2 H2O(g) △H=+484kJ/mol
9、将pH=3的硫酸溶液和pH=10的氢氧化钠溶液相混合,若要使混合后溶液的pH=7,则硫酸溶液和氢氧化溶液的体积比约为:
A 1:2 B 1:9 C 1:10 D 1:20
8、 一定温度下,容积固定的密闭容器中,当下列哪些物理量不再发生变化时,不能表明下述反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态的是:
一定温度下,容积固定的密闭容器中,当下列哪些物理量不再发生变化时,不能表明下述反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态的是:
A B的物质的量浓度 B混合气体的压强
C物质C的百分含量 D混合气体的密度
7、下列关于能量的说法正确的是:
A Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) △H=-216kJ/mol 反应物总能量>生成物总能量
B CaCO3(s)=CaO(s)+CO2(g) △H=+178.5kJ/mol 反应物总能量>生成物总能量
C 101kPa时,2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol H2的燃烧热为571.6kJ/mol
D H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ/mol 含1 molNaOH的溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
6、用铁片与稀H2SO4反应制取H2,下列措施不能使H2的生成速率增大的是:
A加热 B不用铁片,改用铁粉
C增加H+的浓度 D不用稀H2SO4,改用98%的浓H2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com