
题目列表(包括答案和解析)
8.向含有1 mol的FeCl2溶液中通入0.2 mol Cl2,再加入含0.1 mol X2O72- 的酸性溶液,使溶液中Fe2+ 全部恰好氧化,并使X2O72- 还原为Xn+,则n值为
A.2 B.3 C.4 D.5
7.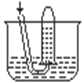 如右图所示,将盛满30 mL
NO2(标准状况,下同)气体的试管倒置于盛有水的水槽中,下列有关说法中正确的是
如右图所示,将盛满30 mL
NO2(标准状况,下同)气体的试管倒置于盛有水的水槽中,下列有关说法中正确的是
A.被氧化与被还原的物质质量比为1︰2
B.若再通入7.5 mL O2,则试管内会充满水
C.若不考虑扩散,最终试管内溶质浓度约为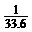 mol/L
mol/L
D.试管内液面的高度约占试管高度的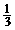
6.都能用右图所示装置进行喷泉实验的一组气体是
(注:烧杯内为NaOH溶液)
A.HCl和CO2 B.NH3和NO
C.SO2和CO D.NO2和NO
5.下列叙述不正确的是
A.金属与HNO3反应主要不产生氢气
B.将标况下,22.4L氨气溶于水配成1L溶液,即可得1mol/L的氨水
 C.1 mol/L的氨水中溶质质量分数小于1.7%
C.1 mol/L的氨水中溶质质量分数小于1.7%
D.常温下可用铁或铝制容器盛装浓HNO3
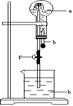
4. 如右图装置中,烧瓶是干燥的,由A口进气收集的气体有
如右图装置中,烧瓶是干燥的,由A口进气收集的气体有
A.NO B.SO2 C.NO2 D.NH3
3.下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O
2.在实验室中,下列物质的保存方法正确的是
①白磷保存在冷水中 ②Na、K保存在水里 ③HF溶液保存在塑料瓶中
④AgNO3固体保存在棕色试剂瓶内 ⑤浓硝酸保存在棕色广口瓶内
A.①③④ B.③④ C.①②③④ D.①②③④⑤
1.某无色酸性溶液中,一定能够大量共存的离子组是
A.Fe2+、Ba2+、NO3-、Cl- B.Na+、NH4+、SO42-、Cl-
C.Na+、K+、CO32-、NO3- D.Na+、K+、MnO4-、Br-
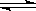 17(6分)、有aA(g)+bB(g) cC(g)+dD(g)的平衡体系,在不同条件的反应混合物中A、B、C的体积分数与时间的关系如图所示。
17(6分)、有aA(g)+bB(g) cC(g)+dD(g)的平衡体系,在不同条件的反应混合物中A、B、C的体积分数与时间的关系如图所示。
(1)若图甲中m、n两曲线表示有无催化剂的情况,则__________表示无催化剂,______表示有催化剂。
(2)若图乙中两曲线表示不同温度下的情况,则T1___________T2 (填“>”、“=”或“<”),正反应为___________热反应。
(3)若丙中P1、P2两曲线表示不同压强下的情况,则P1__________P2,且a+b________c+d (填“>”、“<”或“=”)。
18(6分)、今有a:CH3COOH b:HCl c:H2SO4三种溶液(用a,b,c表示)。
(1)当它们的pH相同时,其物质的量浓度的关系是:________________________
(2)当它们的物质的量浓度相同时,其pH关系是:___________________________
(3)中和同一烧碱溶液,需同浓度的三种溶液的体积关系是:___________________
19(8分)、下图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线。
(1)氮气与氢气反应生成氨气的热化学反应方程式为_________________________________
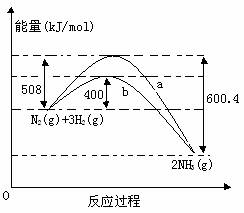 (2)b曲线表示的是_________________________。
(2)b曲线表示的是_________________________。
(3)在同温同压下向密闭容器中通入1 mol N2(g)与
3 mol H2(g),达到平衡时放出的热量为Q1 kJ。
Q1______92.4 kJ(填“>”、“<”或“=”)。
(4)在同温同压下向密闭容器中通入0.5 mol N2(g)、
1.5 mol H2(g)和1 mol NH3(g),达到平衡时放出的热量
为Q2 kJ。Q1_____Q2(填“>”、“<”或“=”)。
20(10分)、在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5 C2O42-+16H+====2Mn2++10CO2↑+8H2O
(1)称取Wg Na2C2O4配成100ml标准溶液时,用到的主要实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、天平和 。
(2)若将所配溶液移取20.00ml置于锥形瓶中,则酸性KMnO4溶液应装在_______________。如何确定滴定终点_______________________________________________________
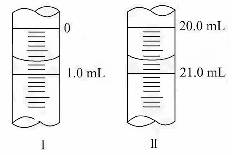
(3)若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为__________________________(填表达式;需要化简)
 (4)实验中下列操作会导致结果偏低的是_________
(4)实验中下列操作会导致结果偏低的是_________
A锥形瓶用蒸馏水洗净后,再用待测液润洗2--3次
B滴定前滴定管尖嘴有气泡,滴定后气泡消失
C滴定前平视读数,滴定后俯视读数
D摇动锥形瓶时,有少量液体溅出
E滴定时,锥形瓶里加入少量蒸馏水稀释溶液
 21(14分)、已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;
21(14分)、已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;
 化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2;
化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2;
在温度973K和1173K情况下,K1、K2的值分别如下:
|
温度 |
K1 |
K2 |
|
973K |
1.47 |
2.38 |
|
1173K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是_____________(填“吸热”、“放热”)反应
 (2)现有反应③:CO2(g)+ H2(g)
CO(g) +H2O(g),请你写出该反应的平衡常数K3的数学表达式___________________________
(2)现有反应③:CO2(g)+ H2(g)
CO(g) +H2O(g),请你写出该反应的平衡常数K3的数学表达式___________________________
(3)根据反应①和②可推导出K1、K2与K3之间的关系式_______________________。据此关系式及上表数据,也能推断反应③是_______________(填“吸热”、“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_________________
A 缩小反应容器体积 B扩大反应容器体积
C 降低温度 D 升高温度
E 使用合适的催化剂 F 设法减小CO的量
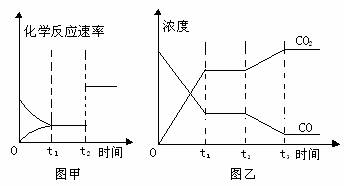 (4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件可能是_________________________________
②图乙中t2时刻发生改变的条件可能是_________________________________
 22(8分)、t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(气) +B(气) xC(气),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
22(8分)、t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(气) +B(气) xC(气),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为____________________
(2)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)=______________mol,
(3)保持温度、容积和原配比不变,改变起始物质的量,反应达到平衡时,C的浓度仍为0.4mol/L,若要使反应从逆反应开始,则C的起始的物质的量n(C)应满足的条件是___________________
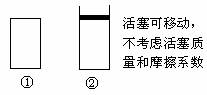
(4)若起始温度相同,对于上述反应,分别向下述两个容器中充入3 mol A和1 mol B,则达到平衡时,两容器中C的体积分数的大小为(填容器编号)________________。
16、已知:H2O(g)= H2O(l) △H1=-Q1kJ/mol CH3OH(g)= CH3OH(l) △H2=-Q2kJ/mol
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=-Q3kJ/mol (Q1 、Q2、 Q3均大于0),若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ):
A Q1+Q2+Q3 B 0.5Q3 +Q2-2 Q1 C 0.5Q3- Q2+2Q 1 D 0.5(Q1+Q2+Q3)
第Ⅱ卷(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com