
题目列表(包括答案和解析)
1、温室效应会导致全球变暖,其主要原因是 ( )
A.CO2增多使太阳辐射到地球表面的能量增多
B.植物的光合作用吸收了CO2
C.CO2能放出能量,使地球变暖
D.CO2、CH4等温室气体产生温室效应,使大气温度上升
21.(8分)某工厂每天要烧掉含硫1.6%的烟煤200t,排放出的SO2严重地污染环境。如果变废为宝,把这些SO2回收利用,那么,在理论上每年(以360天计算)可生产98%的浓硫酸多少吨?
20.(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,
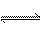 发生反应: N2
(g) + 3 H2(g)
2NH3(g)
发生反应: N2
(g) + 3 H2(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 6.5mol,nt (NH3) = 3mol,a= ;
(2)反应达平衡时,混合气体的体积为358.4L(标况下),其中NH3的含量(体积分数)为25%,
平衡时NH3的物质的量为__ ;
(3)原混合气体与平衡混合气体的总物质的量之比,n(始)∶n(平) = ;
(4)原混合气体中,a∶b = ;
(5)达到平衡时,N2和H2的转化率之比,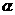 (N2)∶
(N2)∶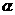 (H2)= ;
(H2)= ;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
19.(15分)已知液氨与水均为10个电子的分子,它们的某些性质相似。如:液氨和水均能发生自偶电离。且液氨电离出的阴阳离子和水电离出的阴阳离子均有10个电子。
(1)写出水的自偶电离方程式: ;
(2)写出液氨的自偶电离方程式: ;
(3)液氨中,阴离子浓度 阳离子浓度(用“>”“<”“=”填写);
(4)写出液氨中阴离子的电子式 ;
(5)写出液氨与钠反应的化学方程式: 。
18.(13分)(Ⅰ)将一定量H2和I2的气体混合物置于容积为2L的密闭容器中,反应进行到4s末,测得H2为0.5mol,I2为0.4mol,HI为0.2mol,
(1)则v (H2)= , v(HI)= ;
(2)反应前I2有 mol。
(Ⅱ)在容积可变的密闭容器中,可逆反应2HI(g) H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:(用“变大”“变小”“不变”“加深”“变浅”“左移”“右移”“不移动”填写)。
H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:(用“变大”“变小”“不变”“加深”“变浅”“左移”“右移”“不移动”填写)。
(1)正反应速率______________;逆反应速率______________;
(2)平衡______________;容器内颜色______________;
(3)H2的质量分数______________;混合气体的平均相对分子质量______________;
(4)HI的转化率______________;混合气体的密度______________。
 (Ⅲ)在容积可变的密闭容器中,向该容器中投入2 mol H2 和1 mol I2(g )可逆反应:
(Ⅲ)在容积可变的密闭容器中,向该容器中投入2 mol H2 和1 mol I2(g )可逆反应:
H2(g)+I2(g ) 2HI(g)已达平衡,此时H2的转化率为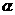 1;若再向该容器中投入4mol H2 和2mol I2(g )此时平衡向______移动(用“左”“右”“不”填写),重新达到平衡时H2的转化率为
1;若再向该容器中投入4mol H2 和2mol I2(g )此时平衡向______移动(用“左”“右”“不”填写),重新达到平衡时H2的转化率为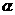 2,
2,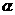 1______
1______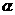 2 (用“>”“<”“=”填写)。
2 (用“>”“<”“=”填写)。
17.(12分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表示为:
□KClO3+□HCl →□KCl+ □ClO2+ □Cl2+□
(1)配平上述化学反应方程式。
(2)浓盐酸在反应中表现的化学性质是( )
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3)生成0.1mol Cl2时转移电子的物质的量为 mol ;
(4)将0.1mol Cl2通入1L含0.15mol 的FeI2溶液中,充分反应后c(I- )= 。
16.在恒容密闭容器中加入4mol
A和2mol
B,发生反应2A(g)+B(g) 3C(g)+D(g)达到平衡时C的浓度为m mol/L,若温度不变时按下列4种配比作为起始物质,达到平衡后C浓度仍为m mol/L的是
3C(g)+D(g)达到平衡时C的浓度为m mol/L,若温度不变时按下列4种配比作为起始物质,达到平衡后C浓度仍为m mol/L的是
A.2molA+1molB B. 4molA+2molB+3molC
C.3molC+1molD D.6molC+2molD
注意:请将选择题答案填在下面的表格中,填在其他地方不给分。
15.常温时,将pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合后,所得溶液的pH
A.等于7 B.大于7
C.小于7 D.无法确定
14.在密闭容器中发生如下反应:xA(g)+yB(g) 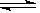 zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是
A.x+y﹥z B.平衡向右移动
C.B的转化率提高 D.C的体积分数降低
13.在合成氨工业中,为增加氨气的产量,在实现此目的的过程中不能用勒夏特列原理解释的是
A.不断将氨分离出来 B.不断地投入N2和H2的量,保证N2和H2的浓度
C.采用500℃的高温 D.采用20-50MPa的压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com