
题目列表(包括答案和解析)
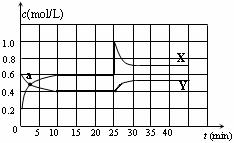
13.已知NO2和N2O4可以相互转化:N2O4(g) 2NO2(g)
△H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是
2NO2(g)
△H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是
A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线
B.a点时v(N2O4) = v(NO2)
C.25 min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强
D.前10 min内用v(N2O4)表示的化学反应速率为0.02 mol/(L·min)
12.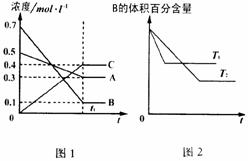 T℃时在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示。则下列结论正确的是
T℃时在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示。则下列结论正确的是
A.保持其他条件不变,升高温度,正、逆反应
速率均增大,且A的转化率增大
B.在达平衡后,保持其他条件不变,增大压强,
平衡向正反应方向移动
C.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
 D.T℃时,若由0.4mol·L –1A、0.4mol·L –1B、0.2mol·L –1C反应,达到平衡后,C的浓度为0.4mol·L –1
D.T℃时,若由0.4mol·L –1A、0.4mol·L –1B、0.2mol·L –1C反应,达到平衡后,C的浓度为0.4mol·L –1
11. 在一定条件下可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是
在一定条件下可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是
A 单位时间生成n molA,同时生成3n molB B C生成的速率与C分解的速率相等
C A、B、C的分子数之比为1:3:2 D A、B、C浓度不再变化
10.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
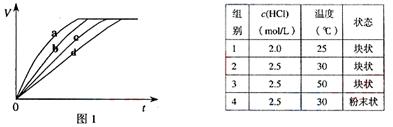
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
9.向某密闭容器中充入1 mol
CO和2 mol
H2O(g),发生反应:CO+H2O(g) CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B. 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
C. 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D. 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
8.S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) =SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) = SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s)= S(正交,s) △H3
下列说法正确的是( )
A.△H3=0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)= S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s)= S(正交,s) △H3<0,单斜硫比正交硫稳定
7.下列反应的离子方程式正确的是( )
A.氢氧化钠溶液中通入少量二氧化硫:SO2+OH- = HSO3-
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3- +Ba2++OH- = BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH- = H2O
D.碳酸钙溶解于稀硝酸中:CO32 -+2H+ = CO2↑+H2O
6.已知汽车尾气无害化处理反应为: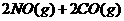

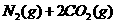
下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,N0的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
5.下列事实,不能用勒夏特列原理解释的是
A.溴水中有下列平衡:Br2+H2O HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)
 H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2  CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成时为提高NH3的产率,理论上应采取低温度的措施 (N2+3H2 2NH3;DH<0)
2NH3;DH<0)
4.一定条件下,可逆反应C(s)
+ CO2(g)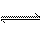 2CO(g);△H>0,达到平衡状态,现进行如下操作:
2CO(g);△H>0,达到平衡状态,现进行如下操作:
①减少体系中CO的量; ②缩小反应体系的体积;
③增加反应物C的用量; ④升高反应体系的温度;
上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④ B.②④ C.③④ D.①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com