
题目列表(包括答案和解析)
1. 下列作用不属于水解反应的是
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
24(6分).工业制氢气的一个重要反应是:
CO(g)+H2O(g)=CO2(g)+H2(g)
已知在25℃时:
⑴C(石墨)+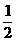 O2(g)=CO(g) △H1=-111kJ·mol-1
O2(g)=CO(g) △H1=-111kJ·mol-1
23.
 已知:合成氨反应为N2+3H2
已知:合成氨反应为N2+3H2  2NH3 △H<0,分析下列问题:
2NH3 △H<0,分析下列问题:
(1).在一定温度时,可用右图中哪一条曲线表示反应物的转化率和压强之间的关系 (填“I”、“II”、“III”)
(2).在不同温度和压强下(P1>P2),合成氨反应达到平衡时,混合气体中氨气的体积分数Z%,随温度变化的曲线应为 (填“A”“B”“C”“D”)
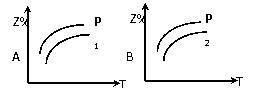
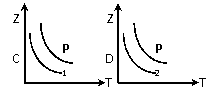
(3).将N2和H2按1:3的体积比通入合成塔,反应达平衡后,NH3的体积分数为20%,则达到平衡时:
N2和H2的转化率之比α(N2)∶α (H2)= ;
平衡时N2的转化率为 ;
平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =
22.(1).相同温度时,向两个开始体积相同的容器中分别充入2molSO2和1molO2,甲容器保持恒压,乙容器保持恒容,达到平衡时(填“>”、“<”、“=”):
反应速率v甲 ______ v乙,SO2的转化率ω甲 _______ ω乙,所需时间t甲 ______ t乙
(2) 在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入a mol和2a mol的HI气体,待反应:2HI(g)  H2(g)+I2(g)均达到平衡时(填“<”、“>”、“=”):
H2(g)+I2(g)均达到平衡时(填“<”、“>”、“=”):
I2的浓度c(I2)A____________c(I2)B,
I2蒸气在混合气体中的体积分数A容器_________B容器
19:(1).卫星发射时可用肼(N2H4)作燃料,1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量。写出反应的热化学方程式:
_________________________________________________;
(2).下列各组离子中,能大量共存的是:________________;
A.Cl-,HCO3-,Na+,H3O+ B.Al3+,SO42-,Na+,OH- C.NH4+,SO42-,K+,OH-
D.Fe3+,SCN-,NH4+,NO3- E.S2O32-,NH4+,SO42-,H+ F.Mg2+,Cl-,NO3-,SO42-
20:某反应的平衡常数表达式为 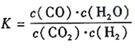 ,恒容时,温度升高H2浓度减小。分析下列问题:
,恒容时,温度升高H2浓度减小。分析下列问题:

(1).该反应的化学方程式为: ,温度升高,该反应的K值__________(填“增大”、“减小”、“不变”,下同。),化学平衡移动后达到新的平衡,CO2和CO体积比_______________。
(2).在一体积为10 L 的容器中,通入一定量的 CO 和H2O, 在850 ℃ 时发生反应,CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=_______________ mol/(L·min),850℃的化学平衡常数的值K=
(3)850℃时,在相同容器中发生反应 CO2+ H2  CO+H2O (g),
t时刻容器内各物质的浓度分别为: 一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时:v(正)
v(逆)(填“>”、“<”、“=”)
CO+H2O (g),
t时刻容器内各物质的浓度分别为: 一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时:v(正)
v(逆)(填“>”、“<”、“=”)
21.在CH3COOH溶液中存在的微粒有 ,要使溶液中的c(H+)浓度减小,且的电离程度增加,下列措施中可行的是:
①加水,②加HCl,③加CH3COONa,④加NaCl溶液
18、对于反应:N2+3H2  2NH3 △H<0,下列图象所示不正确的是
2NH3 △H<0,下列图象所示不正确的是

第II卷(46分)
17.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s) △H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.氢气的燃烧热285.8kJ/mol,氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=+285.8 kJ/mol
D.在稀溶液中H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol若将含0.5 mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
16.已知一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.5molN2和1.5molH2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是
A.2Q2>Q1=92.4kJ B.2Q2=Q1=92.4kJ
C.2Q2<Q1<92.4kJ D.2Q2=Q1<92.4kJ
15.设 C(g)+CO2(g) 2CO(g) △H>0 ,反应速率为 u1,
2CO(g) △H>0 ,反应速率为 u1,
N2+3H2 2NH3 △H<0反应速率为 u2,
2NH3 △H<0反应速率为 u2,
对于上述反应,当温度升高时,u1和u2的变化情况为
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
14.下列事实中能应用勒沙特列原理来解释的是
A.石墨比金刚石稳定。 B.加入催化剂有利于氨的氧化反应
C.高压对合成氨有利 D.500℃左右比室温更有利于合成氨的反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com