
题目列表(包括答案和解析)
12.室温下,在PH=12的碱溶液中,由水电离出来的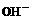 离子浓度为
离子浓度为
A.1×10-14 mol/L B.1×10-6 mol/L
C.1×10-2 mol/L D. 1×10-12 mol/L
11.常温下,分别向体积相同、溶液PH也相同的盐酸和醋酸溶液中投入足量的锌粒,反应生成的氢气较多的是
A.相同 B.醋酸中多
C.盐酸中多 D.不能确定
10.100℃时在水中加入少量的NaHSO4后,则溶液的
A.PH增大
B.c(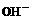 )增大
)增大
C.c(H+)和c(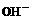 )的乘积不变 D.c(H+)和c(
)的乘积不变 D.c(H+)和c(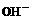 )的乘积增大
)的乘积增大
9.常温下PH=2的某溶液中可以大量共存的离子组是
A.Ca2+ OH- Cl- NO3- B.Ca2+ K+ Cl- NO3 -
C.Cl- NO3- Al3+ Fe2+ D.K+ Cl- Na+ CO32-
8.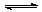 已知:C(s)+CO2(g)
2CO(g) 正反应吸热,反应速度为v1;
已知:C(s)+CO2(g)
2CO(g) 正反应吸热,反应速度为v1;
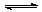 N2(g)+3H2(g) 2NH3(g)正反应放热,反应速度为v2。
N2(g)+3H2(g) 2NH3(g)正反应放热,反应速度为v2。
对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小
C.增大,减小 D.减小,增大
7.可逆反应:3A(g) 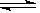 3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是
3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B是溶液、C是固体
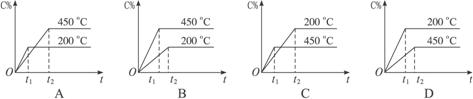
6.对于可逆反应A(g)+B(g) 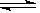 C(g)(正反应是放热反应),下图中表示的生成物C的百分含量(C%)与时间t的关系正确的是
C(g)(正反应是放热反应),下图中表示的生成物C的百分含量(C%)与时间t的关系正确的是
5.反应2A(g)+B(g) 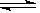 2C(g) (正反应是放热反应)。下列反应条件一定有利于生成C的是
2C(g) (正反应是放热反应)。下列反应条件一定有利于生成C的是
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
4.下列叙述中可以说明2SO2+O2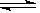 2SO3(g)已达到平衡的是
2SO3(g)已达到平衡的是
①单位时间内生成n mol SO2的同时生成n mol SO3
②条件一定,混合气体的平均相对分子质量不再变化
③百分组成ω (SO2)=ω(SO3)
④反应速率v(SO2)=2v(O2)
⑤c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
A .①②④⑦ B. ①⑤⑥⑦ C. ①②⑥⑦ D. ①②③⑦
3. 能说明醋酸是弱电解质的事实是
A.醋酸溶液的导电性比盐酸弱
B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C.醋酸溶液用水稀释后,氢离子浓度下降
D.0.1mol/L的CH3COOH溶液中,氢离子的浓度约为0.001mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com