
题目列表(包括答案和解析)
21.(8分)某学生用0.1×10×25㎜3,质量分数≥99.5%的铝片和酸反应制取H2,实验现象见下表:
|
|
1min |
2min |
5min |
15min |
20min |
|
3mol/L HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5 mol/LH2SO4 |
均无明显现象(只有少量气泡) |
(1)写出铝片与酸反应的离子方程式 。
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)根据铝片与盐酸和硫酸反应现象的差异,深入思考,可作出如下猜想:
猜想一: 。
猜想二: 。
20.(8分) 高炉炼铁中发生的基本反应之一如下:
FeO(g) +CO(g)  Fe(g) + CO2(g) △H>0其平衡常数可表达为
Fe(g) + CO2(g) △H>0其平衡常数可表达为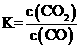 ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值 ,
衡常数K值 (“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选“是”或“否”)。
(3)若加入催化剂,平衡时气体混合物的总物质的量_______。
19.(8分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________________
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________
18.对于可逆反应:下面图像对于平衡体系,mA(g)+nB (g) 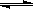 pC(g)+qD (g) DH <0有下列判断,其中正确的是
pC(g)+qD (g) DH <0有下列判断,其中正确的是
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变
为原来的0.6倍,则m+n<q+p
B.若平衡时,A、B的转化率相等,说明反应开始时A、B
的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n>p+q
D.加催化剂或增大压强,一定能实现如图中a→b的变化
第Ⅱ卷(共计46分)
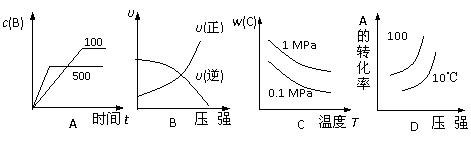
17.对于可逆反应:2A(g)+B(g)  2C(g)
△H<0,下列各图中正确的是
2C(g)
△H<0,下列各图中正确的是

16.已知使36g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+1/2O2(g)= CO(g) DH =-Q1kJ/mol,
CO(g)+1/2O2(g)= CO2(g)DH =-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是
A.1/2Q2 kJ B. Q2 kJ C.1/3(Q1+Q2)kJ D.1/3Q1 kJ
15.某温度下,密闭容器中发生反应aX(g) 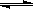 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是 ( )
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是 ( )
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
14. 一定条件下的反应:PCl5(g) PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况使PCl5转化率降低的是 ( )
PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况使PCl5转化率降低的是 ( )
A. 温度、体积不变,充入氯气 B. 温度、体积不变,充入氩气
C. 体积不变,对体系加热 D. 温度不变,增大容器体积
13、下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s); ΔH>0 则金刚石比石墨稳定。
B.已知C(s)+O2(g)= CO2(g);ΔH1 C(s)+1/2O2(g)= CO(g);ΔH2 则ΔH1>ΔH2
C.已知2H2(g)+ O2(g)= 2H2O(g);ΔH= - 483.6kJ/mol 则氢气的燃烧热为241.8 kJ/mol。
D.已知NaOH(aq)+HCl(aq)= NaCl(aq) + H2O(l);ΔH=-57.3kJ/mol 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
12、在一定温度下可逆反应H2(g)+I2(g)
 2HI(g) 达到平衡的标志是
2HI(g) 达到平衡的标志是
A.有1mol H-H键断裂,同时有1 mol I-I键形成
B.容器内压强不再随时间而变化
C.单位时间内反应掉n mol I2 同时生成2n mol HI
D.H2、I2、HI的浓度之比为1∶1∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com