
题目列表(包括答案和解析)
4.下列说法中有明显错误的是 ( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地
增大化学反应的速率
3.下列过程中△H小于零的是 ( )
A. 氯酸钾分解制氧气 B. 氢氧化钡与氯化铵反应
C. 碳酸钙分解制二氧化碳 D. 锌与稀硫酸的反应制氢气
2.已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为( )
H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
A.①②③④ B.③⑤⑥⑦ C.④⑤⑥⑦ D.③④⑤⑥⑦
21、(11分)已知:AlCl3+4NaOH(过量)=NaAlO2+3NaCl+2H2O, 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;有A、B、C、D、E五种溶液,分别是由下列阴阳离子的两两组合而成。
阴离子:NO3-、OH-、SO42-、C1-、CO32- 阳离子:Fe3+、Ba2+、Al3+、Na+、Ag+
①将A溶液与B、C溶液混合,均产生沉淀和气体。
②将B滴入D溶液中,先无沉淀后有沉淀。
(1)根据上述条件能否将A、B、C、D、E五种物质全部确定?
答 (填“可以”或“不可以”)
(2)写出可以确定的物质的化学式(如有不能确定的物质,可以不写)
A B C D E 。
(3)写出下列反应的离子方程式:
①中A+C:
(4)室温时,0.2mol·L-1的B溶液中各种离子浓度由大到小的顺序为
。
成都市七校协作体高2012级第三学期期中试题
20、(12分)某氢氧化钾样品中含有少量不与强酸作用的可溶性杂质,为了测定其纯度,进行以下操作:
A、在250ml容量瓶中配制250ml氢氧化钾溶液;
B、用碱式滴定管量取25.00ml氢氧化钾溶液于锥形瓶中并加几滴甲基橙指示剂;
C、在分析天平上准确称取氢氧化钾样品Wg,在100 mL小烧杯中加蒸馏水溶解;
D、将物质的量浓度为Cmo1·L-1的标准盐酸装入酸式滴定管,调整液面,记下开始刻度数V1mL;
E、在锥形瓶下垫一张白纸,滴定至终点,记录终点时刻度数V2mL。
回答下列问题:
(1)正确的操作步骤的顺序是(填写字母)



 D 。
D 。
(2)滴定管读数时应注意
(3)操作E中的锥形瓶下垫一张白纸,其作用是 。
(4)滴定终点时溶液颜色变化是 。
(5)该氢氧化钾样品纯度的计算式为 。
(6)下列操作中可能使所测氢氧化钾样品纯度偏高的是 。
A、酸式滴定管未用标准盐酸润洗就直接装入标准盐酸进行滴定。
B、滴定前盛放氢氧化钾溶液的锥形瓶用蒸馏水洗净后没有干燥。
C、酸式滴定管在滴定前有气泡,滴定后气泡消失。
D、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数。
19、(13分)常温下,向100ml,0.01mol·L-1HX溶液中逐滴加入0.02mol·L-1MOH溶液,右下图中所示曲线表示混合溶液的PH变化情况(体积变化可忽略不计)。
回答下列问题:
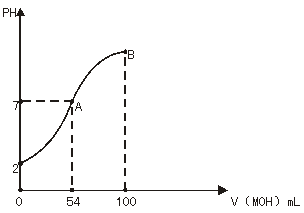 (1)由图中信息可知HX为 酸(填“强”或“弱”),
(1)由图中信息可知HX为 酸(填“强”或“弱”),
理由是
(2)常温下,一定浓度的MX稀溶液的PH=a,
则a 7(填“>”“<”或“=”),用离子
方程式表示其原因为
此时溶液中由水电离出的c(OH-)= mol·L-1。
(3)请写出B点所对应的溶液中离子浓度的大小顺序为
(4)B点对应的溶液中,c(M+)+c(MOH) 2c(X-)(填“=”、“>”、“<”);
若此时溶液中PH=11,则c(MOH)+c(OH-)= mol·L-1
18、(10分)已知:室温时A酸溶液PH=a,B碱溶液PH=b
(1)若A为盐酸,B为NaOH
①若a+b=14,两者等体积混合后溶液的PH= 。
②酸碱按体积比10:1混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为NaOH,则a=4,b=12,则A溶液中水电离出的氢离子浓度是B中水电离出的氢离子浓度 倍。
(3)若A为醋酸a=3;B为NaOH,B中c(H+)/c(OH-)=10-8;
用体积为VA的醋酸和体积VB的氢氧化钠混合呈中性,则其体积关系VA VB,混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)。(填“=”、“>”、“<”、“≥”、“≤”)
(4)若A的化学式为HnR,B的化学式为M(OH)n且为强碱,两者混和时生成正盐,该盐呈碱性,写出该盐水解的离子方程式: 。
17、(6分)在一定温度和一定压强下,把1.0体积N2和3.0体积H2通入一个带活塞的体积可变的容器中,如图反应如下:N2+3H2 2NH3,若反应达到平衡后,测得混合气体为3.5体积,试回答。
2NH3,若反应达到平衡后,测得混合气体为3.5体积,试回答。
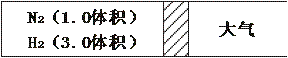
(1)在上述装置中,若需控制平衡后的混合气体为3体积,则可采取的措施是 ,原因 。
(2)保持上述反应温度不变,设a、b、c(a:b=1:3)分别代表初始加入的N2、H2、NH3体积,如果反应达到平衡后,混合气体中各物质的体积分数仍与上述平衡完全相同,那么:
①a=2.0 c=4.0 则b= 在此情况下,起始时反应将向 反应方向进行(填正或逆),达到平衡。
②若规定起始时反应向逆反应方向进行,则c的取值范围为 (用含a或b的式子表示)。
16、下列说法中正确的是
A、PH=3与PH=1的硫酸溶液中c(CH+)之比为1:100;
B、K2S溶液中c(K+)与c(S2-)之比为2:1;
C、0.4mol·L-1氨水与0.2mol·L-1的氨水中c(OH-)之比为2:1;
D、用同一浓度的盐酸中和相同体积,PH相同的氨水和烧碱溶液,所需盐酸的体积相同。
Ⅱ卷 (共52分)
选择题答题栏:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com