
题目列表(包括答案和解析)
1.下列说法中,在科学上没有错误的是( )
A.吸带过滤嘴的香烟,对人体无害
B.保护环境就是保护人类自己
C.纯天然物质配成的饮料,不含任何化学物质
D.水可以变为油
21、(10分) 将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 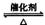 2SO3
ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
2SO3
ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改用效率更高的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)为__________。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀________克?
20、(12分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6 + I2 = C6H6O6 + 2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol/LCH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中。加入1mL指示剂,立即用浓度为0.05000mol/L的I2溶液进行滴定,直至滴定终点,共消耗20.00mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)所用的指示剂为______________
(3)在滴定过程中,应用左手控制滴定管的_________(填部位),右手摇动锥形瓶,眼睛注视_________________________,直到滴定终点。滴定至终点时的现象是________________。
(4)样品中维生素C的质量分数为_____________。
19、(12分)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月才充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
(1)该电池反应的总离子方程为 ;
(2)甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填“下降”或“上升”、“不变”);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO4溶液,(假设整个过程中能量总利用率为80%),则将产生标准状况下的O2 升。
(3)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为 ___________;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
18、(9分)
(1) t ℃时,测得纯水中c(OH-)=2×10-7 mol·L-1,则t(填“>”、“<”或“=”) 25℃,该温度下,水的离子积常数为 。该温度下,某K2SO4溶液中c(SO42-)=1×10-4mol·L-1,取该溶液1 mL 加水稀释至100 mL,则稀释后的溶液中c(K+)∶c(H+)= 。
(2)25℃时,将pH=1 的H2SO4溶液a mL 与pH=12 的NaOH溶液 b mL混合后,所得溶液的pH=3,则a∶b= ;反应后,溶液中各离子浓度由大到小的顺序是 。
17、(9分)已知:2H2(g)+ O2(g)=2H2O(g); △H= -484 kJ/mol,2H2(g)+ O2(g)=2H2O(l);
△H= -572kJ/mol,若在标准状况下H2和O2组成的混合气体点燃,爆炸后再恢复到标准状况,气体体积减少33.6L,则反应放出的热量是 ____________________kJ。
将0.3moL的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼的液态水,放出660 kJ热量,该反应的热化学方程式为_______________________________________________.
又已知:H2O(l)=H2O(g) △H=+44kJ/mol,则2.24 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
16、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是:( ) A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
15、用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A、27mg B、54mg C、108mg D、216mg
14、pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系量是( )
A、m=n B、m>n C、m<n D、无法判断
13、关于电解NaCl 水溶液,下列叙述正确的是( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com