
题目列表(包括答案和解析)
3.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
A.溴苯中的溴(KI溶液) B.乙烷中的乙烯(酸性高锰酸钾溶液)
C.乙炔中的H2S(硫酸铜溶液) D.苯中的甲苯(Br2水)
2.下列反应,属于加成反应的是( )
A.乙烯使酸性KMnO4溶液褪色 B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色 D.甲烷与氯气混合,光照一段时间后黄绿色消失
1.下列各组混合物可以用分液漏斗分离的是( )
A.溴和四氯化碳 B.苯和溴苯 C.苯和甲苯 D.硝基苯和水
1*、(4分)已知相同条件下同浓度的NaCN与NaF的稀溶液,前者的pH值大于后者,相同条件下比较同浓度同体积两种溶液中的关系,其中正确的是
A.c(CN-)>c(F-) B. c(CN-)=c(F-)
C.NaCN水解程度比NaF大 D.NaCN电离程度比NaF大
2*、(8分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)______________________________________________。
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______0.11mol/L(填“>”、“=”、“<”)。
(3)0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________________。
25、(1)PH=12的氢氧化钠溶液加水稀释100倍,求稀释后的PH
(2)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。
22、(10分)在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
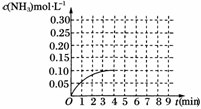 N2(g)+3H2(g)
N2(g)+3H2(g)
 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
(1)根据右图,计算从反应开始到平衡时,平均反应速率υ(NH3)=____________ mol·L-1·min-1。
(2)该反应平衡常数表达式K=____________。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡____________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
21、(12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
 ① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②使滴定管尖嘴充满液体, 固定好滴定管
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(3)图19是某次滴定时的滴定管中的液面,其读数为 mL
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L
|
滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.40 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.00 |
|
第三次 |
20.00 |
2.00 |
24.10 |
19(8分)下表中的数据表示破坏1 mol物质中的化学键需消耗的能量(即键能):
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
键能/kJ·mol-1 |
436 |
243 |
431 |
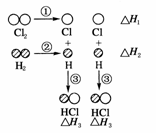 H2和Cl2反应生成HCl过程中的热效应可用右图表示,请回答下列问题:
H2和Cl2反应生成HCl过程中的热效应可用右图表示,请回答下列问题:
(1)ΔH1=__________kJ·mol-1,该反应的热化学方程式为___________________________________________。
(2)据实验测定,H2和Cl2的混合气体在光照下反应生成HCl引发该反应的步骤是上图①-③中分子转化为原子的一步,你认为是第____________(填序号)步,请说明原因:____________________________________________________________________________________________。
20、(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
① |
0.1 |
0.1 |
pH=9 |
|
② |
c |
0.2 |
pH=7 |
|
③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?____________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____________0.2 mol/L(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是____________。
(3)从③组实验结果分析,说明HA的电离程度____________NaA的水解程度(选填“大于”、“小于”或“等于”),
18、在相同浓度下,在PH=9的氢氧化钠和醋酸钠两种溶液中,设由水电离产生的c(OH-)分别为amol/L与bmol/L,则a与b的关系为( )
Aa>b Ba=10-4b Cb=10-4a Da=b
第Ⅱ卷(非选择题 共46分)
17、已知一种c(H+)=1×10-3mol/L 的酸和一种c(OH-)=1×10-3mol/L的碱溶液以等体积混合后,溶液呈酸性,其原因可能是 ( )
A.浓的强酸和稀的强碱反应 B.浓的弱酸和稀的强碱反应
C.等浓度的强酸和弱碱反应 D.生成了一种强酸弱碱盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com