
题目列表(包括答案和解析)
20.(9分)(1)通过实验测定化学反应速率的方法有多种,如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的____________来实现;在KMnO4与H2C2O4反应中,可通过测定____________________________来测定该反应的速率;在Na2S2O3和H2SO4反应中,该反应的速率可通过__________________________来测定。
(2)影响化学反应速率的因素很多,在下列事实中什么因素影响了化学反应速率:
①黄铁矿煅烧时要粉碎成矿粒:________________________;
②熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:________________;
③同浓度、同体积的盐酸放入同样大小的锌片和镁片,产生气体有快有慢:____________;
④同样大小的石灰石分别在0.1 mol/L的盐酸和1.0 mol/L的盐酸中反应速率不同:
___________________________;
⑤夏天的食品易霉变,而冬天不易发生该现象:__________________________;
⑥集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时发生爆炸:_______________。
19.(9分)现有可逆反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转
pC(g),达到平衡后,当升高温度时,B的转
化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为_____________反应(填“放热或“吸热”),且m+n________p(填
“>”“=”或“<”)。
(2)减压时,A的质量分数____________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率______________,B的转化率____________。
(4)若升高温度,则平衡时B、C的浓度之比将_____________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色____________(填“变深”“变浅”或“不变”下同);而维持容器内压强不变,充入氖气时,混合物颜色_______。
18.(7分)2010年10月1日下午18时59分57秒,我国探月二期工程先导星“嫦娥二号”在西昌点火升空,准确入轨,赴月球拍摄月球表面影象、获取极区表面数据,为“嫦娥三号”在月球软着陆做准备。 “嫦娥二号”的成功发射,标志着中国探月工程又向前迈出重要一步。承担这次发射任务的是“长征三号丙”运载火箭,这也是“长征三号丙”运载火箭首次担负月球探测卫星发射任务。
(1)“长征三号丙”运载火箭助推器一、二子级是以液态四氧化二氮(N2O4)和液态偏二甲肼(C2H8N2)为推进剂的。已知5.0g液态偏二甲肼与足量液态四氧化二氮完全反应放出212.5KJ的热量,生成物是对环境无害的氮气、二氧化碳和水蒸气。写出该反应的热化学方程式_________________________________________________________________________。
(2)“长征三号丙”运载火箭助推器三级是以低沸点的液氢和液氧为推进剂的,在发射过程中氢气燃烧生成水蒸气。已知1g氢气完全燃烧生成液态水时放出142.9KJ热量,又知1mol液态水变成水蒸气需要吸收44.0kJ热量,写出在火箭发射过程中氢气燃烧的热化学方程式___________________________________________________________;氢气做能源的优点有__________________________、__________________________、_____________________。
17.(11分)2SO2 (g)+O2 (g) ===2SO3 (g)反应过程的能量变化如下图所示。已知1mol SO2 (g)氧化为1mol SO3(g) 的ΔH=-99.0KJ·mol-1。请回答下列问题:
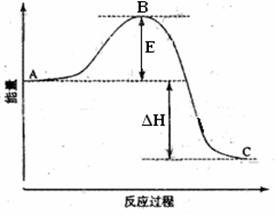
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加入V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
。(2)图中△H= KJ·mol-1。
(3)已知单质硫的燃烧热为296 KJ·mol-1,则由S(s)生成3 molSO3(g)的△H为_________。
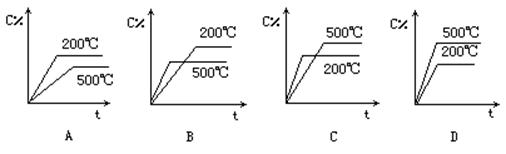
16.对于反应A(g)+2B(g)
 2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
第二卷 非选择题 (共52分)
15. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g)。平衡时测得A的
zC(g)。平衡时测得A的
浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A
的浓度降低为0.30 mol/L。下列有关判断错误的是
A.x+y<z B.平衡向逆反应方向移动
C.B的转化率降低 D.C的体积分数下降
14.下列与化学反应能量变化相关的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
13.下列叙述中能肯定判断某化学平衡发生移动的是
A.混合物各组分的浓度发生改变
B.混合体系中气体密度发生改变
C.正逆反应速率发生改变
D.反应物的转化率发生改变
12.一定条件下反应2HI(g)
 I2(g)+H2(g)达到平衡状态的标志是
I2(g)+H2(g)达到平衡状态的标志是
A.单位时间内生成n mol I2,同时消耗2n mol HI
B.容器内气体的压强不在随时间的变化而变化
C.HI的消耗速率等于H2的消耗速率
D.容器中各组分的体积分数不在随时间变化而变化
11.下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com