
题目列表(包括答案和解析)
25、(10分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 克。
24、(5分)(1) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)  2SO3(g)
2SO3(g) 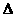 H = -190 kJ·mol-1
H = -190 kJ·mol-1
该热化学反应方程式的意义是 ____________________________________ 。
(2) 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知: CO (g)+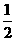 O2 (g) = CO2 (g)
O2 (g) = CO2 (g) 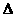 H = -283.0
kJ·mol-1
H = -283.0
kJ·mol-1
S (g)+ O2 (g) = SO2 (g) 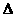 H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1
此反应的热化学方程式是__________________________________________________。
23、(6分)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
(1)检查图1所示装置气密性的方法是_______________________________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量_______________________________________________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1-t2时间段内反应速率逐渐加快的主要原因是_________________________________________________________。
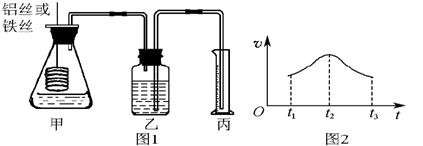
22、常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:(已知:N2O4 2NO2 △H >0)
2NO2 △H >0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,下列说法中正确的是 ( )
①(a)甲>乙;②(a)甲<乙 ;③(b)甲>乙;④(b)甲<乙
A.①③ B.①④ C.②③ D.②④
第Ⅱ卷
21、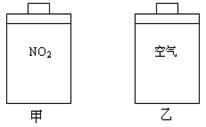 在容积不变的密闭容器中,一定条件下发生反应:2A
在容积不变的密闭容器中,一定条件下发生反应:2A B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入惰性气体,则平衡向右移动
20、密闭容器中X、Y、Z三种气体的初始浓度和不同温度下的平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
25℃时初始浓度/mo1·L-1 |
0.1 |
0.2 |
0 |
|
25℃时平衡浓度/mo1·L-1 |
0.05 |
0.05 |
0.1 |
|
50℃时平衡浓度/mo1·L-1 |
0.06 |
0.08 |
0.08 |
下列说法错误的是 ( )
A.该反应是放热反应
 B.该反应可表示为X+3Y 2Z
B.该反应可表示为X+3Y 2Z
C.增大压强使平衡向生成Z的方向移动,X浓度减小
D.反应达到平衡时,Y的分解速率是Z的分解速率的1.5倍
19、CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是 ( )
①铜片做阴极,石墨做阳极 ②铜片做阳极,石墨做阴极
③阳极有氧气生成 ④阴极有氢气生成
⑤白色沉淀在阳极附近生成 ⑥白色沉淀在阴极附近生成
⑦阳极区溶液变蓝的原因是2Cu+4I――4e-=2CuI↓+I2 碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH――4e―=2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝
A.只有②④⑤⑦ B.只有①④⑥⑦ C.只有②③⑤⑧ D.只有①③⑥⑧
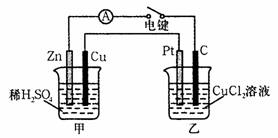
18、如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是 ( )
 A.溶液的质量变化:甲减小乙增大
A.溶液的质量变化:甲减小乙增大
B.溶液pH值变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲 = V乙
D.电极反应式:甲中阴极:Cu2+ + 2e- Cu,
乙中负极:Mg-2e- Mg2+
17、钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是 ( )
A. 负极发生的反应为:Fe-3e- = Fe3+
B. 正极发生的反应为:2H2O+O2+2e- = 4OH-
C. 原电池是将电能转变为化学能的装置
D. 钢柱在空气与水交界处比在水下部分更容易腐蚀
16、电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 ( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.铅蓄电池工作时Pb在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com