
题目列表(包括答案和解析)
28.(6分)将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K.1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。
 根据以上资料回答下列问题:
根据以上资料回答下列问题:

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
___________(选填“A”.“B”或“C”);
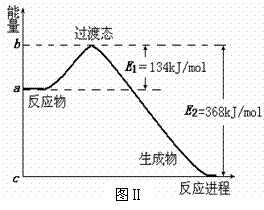
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ___ ________ _______________;
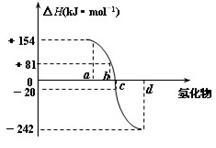
(3)下图为氧族元素的氢化物a.b.c.d的生成热数据示意图。请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(△H)之间的关系:___________________。
27.(6分)硼酸(H3BO3)在食品.医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3
+3CH3OH B(OCH3)3
+3H2O中,H3BO 3的转化率(
B(OCH3)3
+3H2O中,H3BO 3的转化率( )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
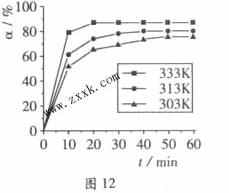
①温度对应该反应的反应速率和平衡移动的影响是____ 、 ___。
②该反应的 _____0(填“<”.“=”或“>”).
_____0(填“<”.“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
26.(14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1.K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A.B中生成的N2O4的速率是VA_________VB。(填“>”.“<”.“=”);若打开活塞K2,气球B将__________(填:变大.变小.不变)。
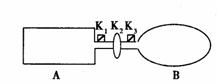
(2)若在A.B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小.不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填: 变大.变小.不变)。
(3)室温下,若A.B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________
25.在锌与某浓度的盐酸起反应的实验中,一个学生得到如下结果:
|
序号 |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶解于酸的时间/s |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
30 |
t1 |
|
E |
2 |
薄片 |
35 |
50 |
|
F |
2 |
颗粒 |
15 |
t2 |
|
G |
2 |
粉末 |
15 |
t3 |
则下列说法正确的是:①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C.只有② D.全部正确
试 卷 Ⅱ 非选择题
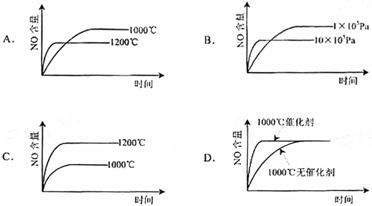
24.已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
23.下列不能用勒沙特列原理解释的是
A.用排饱和食盐水法收集Cl2
B.棕红色NO2加压后颜色先变深后变浅
C.打开汽水瓶时,有大量气泡溢出
D.H2.I2.HI平衡混和气加压后颜色变深
22.人体血液的正常pH约为7.35-7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3-
 H2CO3
H2CO3
 CO2+H2O
CO2+H2O
H++PO43- HPO42- H++HPO42-
HPO42- H++HPO42- H2PO4-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是:
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小。
21.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为: 2Li++FeS+2e-=Li2S+Fe 有关该电池的下列中,正确的是
A. Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B. 该电池的电池反应式为:2Li+FeS=Li2S+Fe
C. 负极的电极反应式为Al-3e-=Al3+
D.
充电时,阴极发生的电极反应式为: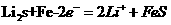
20.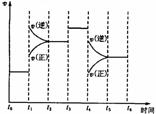 右图表示反应N2(g)+3H2(g)
右图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0-t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是
2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0-t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是
A t0-t1 B t2-t3 C t3-t4 D t5-t6
19.在温度.容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温.恒容,测得反应达到平衡时的有关数据如下(已知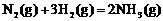
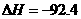 kJ·mol
kJ·mol )
)
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1mol N2.3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L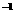 ) ) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
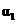 |
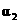 |
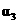 |
下列说法不正确的是
A.2c1<c3 B.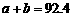 C.
C.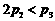 D.
D.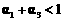
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com