
题目列表(包括答案和解析)
1.有关糖类物质概念的叙述中,正确的是
A.糖类是具有甜味的物质
B.糖类是具有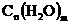 通式的物质
通式的物质
C.葡萄糖是一种单糖的主要原因是一种多羟基醛
D.淀粉是一种白色粉末,本身没有甜味
32.(10分)为验证氯、溴、碘单质非金属性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
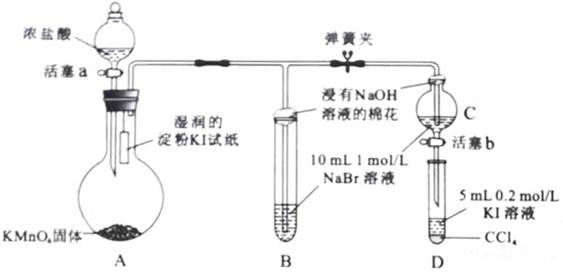
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.……
(1)验证氯气的非金属性强于碘的实验现象是 。
(2)B中溶液发生反应的离子方程式是 。
(3)为验证溴的非金属性强于碘,过程Ⅳ的操作是 。
(4)过程Ⅲ实验的目的是 。
(5)氯、溴、碘单质的非金属性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
福州高级中学2009-2010学年第二学期期中考试
31.(5分) A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子L电子层有2个未成对电子,电子总数是E原子电子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_________,E元素的原子结构示意图是__________________
(2)化合物乙属于________晶体
(3)E单质在一定条件下与甲反应的化学方程式为____________________________。
30.(10分) 短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。回答:
(1)上述六种元素中, 元素的原子的第一电离能最大,理由是:
。
(2)C元素原子的第一电离能 D(填“>”“<”“=”)。
(3)上述六种元素按电负性从小到大的排列是 。
(4)C、D、E、F元素形成的最高价氧化物属于离子晶体的是 。
(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是: 。
29.(7分) A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d轨道为半充满,D元素的基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E元素的基态原子的电子排布式为 。
24.几种短周期元素的主要化合价及原子的原子半径数据见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
主要化合价[] |
+2 |
+3 |
+6、-2 |
+7、-1 |
-2 |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
据表中信息判断,下列有关叙述中,正确的是
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物
C.M与T形成的化合物能和强酸、强碱反应
D.L与R两元素形成的化合物中,含有共价键 四.填空题(本题包括3小题,共32分)
23.有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,下列说法正确的是
A.M与R的质子数之和一定等于21
B.若M在第3周期,则R一定在第2周期
C.M2-可能比R+的离子半径小
D.M与R的原子序数之差可能等于7
22.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质是一种重要的半导体材料。下列说法中,正确的是
A. X、M两种元素只能形成X2M型化合物
B. W、Z、M元素的氢气化物沸点依次降低
C. 元素X、Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理中的消毒剂
21.下列判断错误的是
A.含有金属阳离子的晶体不一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比离子晶体的高
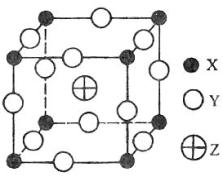 19.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
19.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
A.ZXY3 B.ZX2Y6
C.ZX4Y8 D.ZX8Y12
20.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17; X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y>Z B.离子的还原性:X>W
C.氢化物的稳定性:X>W D.原子半径:X>Y>Z
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com