
题目列表(包括答案和解析)
20.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB == Na+
+ HB-,②HB- H++B2-,③HB-+H2O
H++B2-,③HB-+H2O  H2B+OH-
H2B+OH-
且溶液中c(H+)>c(OH-),则下列说法一定正确的是
A.NaHB为强电解质 B.H2B为强酸
C.NaHB弱电解质 D.HB-的电离程度小于HB-的水解程度
第二卷 非选择题(共50分)
19.常温下,有甲、乙两份体积均为l L,浓度均为0.1mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol/L的盐酸混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=bmol。则a、b正确的答案组合是
A.9-11之间; 0.1 B.9-11之间; 0.2
C.12-13之间; 0.2 D.13; 0.1
18.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中
c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有
c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
17.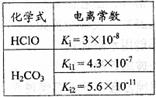 根据右表提供的数据,判断在等浓度的
根据右表提供的数据,判断在等浓度的 、
、 混合溶液中,各种离子浓度关系正确的是
混合溶液中,各种离子浓度关系正确的是
 A.
A.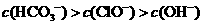
 B.
B.
 C.
C.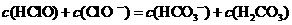
 D.
D.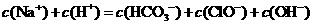
16.一元碱A与0.01 mol/L的一元强酸等体积混合后所得溶液的pH为7。以下说法中正确的是
①若A为强碱,其溶液的物质的量浓度等于0.01 mol/L
②若A为弱碱,其溶液的物质的量浓度大于0.01 mol/L
③反应前,A溶液中c(OH-)一定是0.01 mol/L
④反应后,混合溶液中阴离子的浓度大于阳离子的浓度
A.①② B.①③ C.①②③ D.①②③④
15.已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱溶液 B.降低温度 C.加少量冰醋酸 D.加水
14.在相同温度和压强下,对反应CO2(g) + H2(g) CO(g)
+ H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)
+ H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
  物质的量 物质 物质的量 物质实验 |
CO2 |
H2 |
CO |
H2O |
|
甲 |
a mol |
a mol |
0 mol |
0 mol |
|
乙 |
2a mol |
a mol |
0 mol |
0 mol |
|
丙 |
0 mol |
0 mol |
a mol |
a mol |
|
丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n (CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
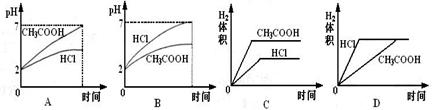
13.在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是
12. 一定温度下,一定量的水中,石灰水悬浊液中存在溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰(恢复原温度),下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰(恢复原温度),下列说法中正确的是
A.n(Ca2+)增加 B.c(Ca2+)不变 C.n(OH-)不变 D.c(OH-)增加
11.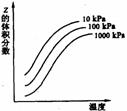 右图是温度和压强对X+Y
右图是温度和压强对X+Y 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A X和Y中只有一种为气态,Z为气态
B X、Y、Z均为气态
C 上述可逆反应的正反应为放热反应
D 上述反应的逆反应的吸热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com