
题目列表(包括答案和解析)
1.下列物质中属于强电解质的是( )
A.H2O B.H2SO3 C.盐酸 D.NH4C1
22.
 (9分)已知:CH2=CH-CH=CH2
+ CH2=CH2 ∆ 物质A在体内脱氢
(9分)已知:CH2=CH-CH=CH2
+ CH2=CH2 ∆ 物质A在体内脱氢
酶的作用下会氧化为有害物质GHB。如图是有关物质A的一种制备方法 及由A引起的一系列化学反应。
 HCHO
HCHO
催化剂 2H2 A 脱氢酶 B
①
催化剂 C4H10O2 C4H8O2
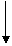
③ 浓硫酸 ∆ 氧化
E CH2=CH-COOH D
C7H10O2 ④ C4H6 GHB
C4H8O3
请回答下列问题: C(环状) ② 浓硫酸 ∆
C4H6O2
(1)写出反应的类型:反应①: 反应③:
 (2)写出化合物B的结构简式:
(2)写出化合物B的结构简式:
(3)反应④中除生成E外,还可能存在一种副产物(含 结构),它的结构简式为
(4)与化合物E互为同分异构体的物质不可能为 (填选项)
A醇 B.醛 C.羧酸 D.酚
(5)写出②的化学方程式
(6)写出④化学方程式
21. (7分)在1000C时,将0.100mol的N2O4气体充入1L的真空密闭恒容容器中,已知容器中的反应为N2O4(g) 2NO2(g) ∆H>0 。每间隔20秒对该容器内的物质进行分析,得到数据如表,请回答:
(7分)在1000C时,将0.100mol的N2O4气体充入1L的真空密闭恒容容器中,已知容器中的反应为N2O4(g) 2NO2(g) ∆H>0 。每间隔20秒对该容器内的物质进行分析,得到数据如表,请回答:
|
时间(S) 浓度 (mol/L) |
0 |
20 |
40 |
60 |
80 |
|
C(N2O4) |
0.100 |
a |
0.050 |
c |
d |
|
C(NO2) |
0.000 |
0.060 |
b |
0.120 |
0.120 |
(1)20S时N2O4浓度a= ;在0~20S内N2O4的平均反应速率为
表中bcd之间的大小关系为 。
(2)该反应达到平衡时N2O4的转化率为 ;若对该平衡混合气进行加热,则其平均相对分子质量将 (填“增大、减小、不变”)。
(3)若在相同条件下,最初向该容器中充入的是NO2气体,要达到上述相同的平衡状态,NO2的起始浓度应为 。
(4)若在相同条件下,往原平衡体系中再通入0.20molNO2气体,重新达到平衡时容器内的NO2物质的量为 。
A.大于0.12mol,小于0.24mol B.等于0.24mol
C.大于0.24mol,小于0.32mol D.等于0.32mol
20.(6分)已探明我国的锰矿储量占世界第三位,,但富矿只占6.4%,每年尚需进口大量的锰矿石,有人设计了把我国的贫菱锰矿(MnCO3含量低)转化为高品位的“菱锰矿砂”的绿色工艺。该工艺的流程如图:
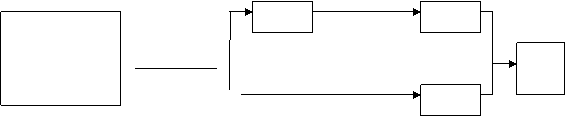 冷却
冷却
贫菱锰矿 固体B 用水溶解,过滤 溶液C
②
(NH4)2SO4 ①4500C 菱锰
质量比2:1 焙烧1.5h 过滤 矿砂
气体A
已知:焙烧反应①的化学方程式为 4500C
(NH4)2SO4 +MgCO3======MnSO4+2NH3↑+CO2↑+H2O
(1)写出②的离子方程式 。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、 、 。从物料平衡的角度看,理论上生产过程中 添加(NH4)2SO4(填“需要”或“不需要”)。
(3)向物质的量浓度均为0.01mol/L的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液先沉淀的是 (填离子符号);当两种沉淀共存时,溶液中C(Ba2+)/C(Mn2+)= 。 [Ksp(BaCO3)=8.1×10-9, Ksp(MnCO3)=1.8×10-11]
19.(8分)A、B、C、D、E、F是元素周期表中连续三个短周期的元素,且原子序数依次增大,A与D同主族,B、C同周期且相邻,C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与F的最外层电子数相等,E的简单离子为同周期中离子半径最小的。回答下列问题:
(1)A与B形成的一种液态化合物M与C的一种单质的摩尔质量相等,则M的
化学式为 ;
(2)A与C形成的一种具有氧化性的液态化合物N和M恰好完全反应,产生两种无毒又不污染环境的物质X和Y。已知:1molM与氧气反应生成X和Y放出的热量为Q1
KJ,N生成1molC单质吸收的热量为Q2KJ。请写出常温常压下M与N反应的热化学方程式 .
(3)A与B形成的另一种气态化合物Z,写出实验室制取Z的化学方程式
。
(4)C与D按原子个数比1:1形成的化合物的电子式为:
(5)六种元素中的其中三种组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液显碱性的原因:
(6)E的单质与D的最高价氧化物对应的水化物反应的化学方程式:
。
(7)A单质与C单质组成新型燃料电池,写出以KOH为电解质溶液的负极电极反应式: 。
18.(6分)(1)已知在常温下测得浓度均为0.1mol/L的下列溶液的PH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
PH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
根据上述信息判断,浓度均为0.5mol/L的下列6种溶液,PH最小的是 (填序号);其PH为 (填数值);PH最大的为 (填序号)
① C6H5OH②CH3COOH③HCN④HClO⑤H2SO4⑥HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的一个规律:
;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,请写出反应的离子方程式 。
17.(9分)回答下列各小题:
 (1)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。
(1)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。
在NaHSO4溶液中,C(H+) C(OH-)+C(SO42-)(填"<"">""=")
(2)常温下,向0.1mol/L的NaHSO4溶液中滴入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡的体积关系如图所示。a、b、c、d为实验时不同阶段的溶液。其中b点所示的溶液呈 性(填“酸性、“中性”、“碱性”),c点所示的离子方程式为
(3)在T0C时,将NaHSO4晶体加到PH=6的蒸馏水中,保持温度不变,测得溶液的PH=2。T0C将 250C(填“高于”或“低于”1分),Kw为 ,在该溶液中水电离出的C(H+)为 mol/L 。
(4)0.1mol/L PH=4的NaHB溶液中①C(H2B)②C(HB-)
③C(B2-)由大到小的顺序是
(5)在0.1mol/L的 ①(NH4)2SO4溶液 ②NH4HCO3溶液
③NH4HSO4溶液 ④NH4Cl溶液中,C(NH4+)由大到小 (序号)
16.
 (10分)煤化工生产中常需研究在不同温度下的化学平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g) H2(g)+
CO2(g)平衡常数随温度的变化如下表:
(10分)煤化工生产中常需研究在不同温度下的化学平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g) H2(g)+
CO2(g)平衡常数随温度的变化如下表:
|
温度/0C |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)上述正反应是 反应(填:“放热”或“吸热”)。
(2)在8000C发生上述反应,以表中的物质的量投入恒容反应容器,,其中向正反应移动的有 (填序号)。
|
序号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
|
E |
3 |
1 |
2 |
1 |

 (3)已知在一定温度下,C(s)
+ CO2(g) 2CO(g)平衡常数为K,C(s) +H2O(g) CO(g)+H2(g)平衡常数为K1;CO(g)+H2O(g) H2(g)+CO2(g)平衡常数为K2。则K、K1、K2之间的关系为是:
。
(3)已知在一定温度下,C(s)
+ CO2(g) 2CO(g)平衡常数为K,C(s) +H2O(g) CO(g)+H2(g)平衡常数为K1;CO(g)+H2O(g) H2(g)+CO2(g)平衡常数为K2。则K、K1、K2之间的关系为是:
。
(4)若在5000C时进行,设起始时CO和H2O初始的浓度均为0.020moL/L,求该条件下CO的平衡转化率(写出计算过程,)。
(5)在VL容器中通入10 mol CO和10 mol水蒸气,在T0C达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842KJ(已知CO的燃烧热为283KJ/mol,H2的燃烧热为286KJ/mol),则T0C的平衡常数K为 。
15.用0.10mol/L的NaOH溶液滴定50mL0.10mol/L的盐酸时,如果滴定体积的相对误差在+0.1%以内,反应完毕后,溶液的PH范围为( )(lg2=0.3)
A.6.0~8.0 B.6.9~7.1 C.4.3~9.7 D.3.3~10.7
第II卷 非选择题(共55分)
14.下列反应的离子方程式书写不正确的是( )
A.饱和NH4HCO3溶液和饱和食盐水混合:HCO3-+Na+=NaHCO3↓
B.在NH4Al(SO4)2中滴加少量Ba(OH)2溶液:NH4+ + SO42-+OH-+Ba2+= BaSO4↓+NH3.H2O
C. Ba(OH)2溶液中滴入NaHSO4溶液至中性:Ba2++2OH-+SO42-+2H+= BaSO4↓+2H2O
D.1mol.L-的KAlO2溶液和2.5mol/L硝酸等体积混合:2AlO2-+5H+=Al(OH)3↓+H2O+Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com