
题目列表(包括答案和解析)
13.氯气溶于水后达到平衡,若其它条件不变,只改变某一条件,下列说法正确的( )
A.再通入少量氯气,C(H+)/C(ClO-)减小 B.通入少量SO2,溶液的漂白性增强
C.加入少量的固体NaOH,一定有C(Na+)=C(Cl-)+C(ClO-)
D..加入少量的固体NaOH,溶液的PH会略微增大
12.将1mol下列物质置于10L水中充分搅拌后,溶液中阴离子数最多的是( )
A.NaCl B.CaF2 C.K2HPO4 D.MgSO4
11.为了更合理地表示溶液的酸碱性,科学家提出”酸度”(用AG表示)的概念,
AG=lg[C(H+)/C(OH--)],下列说法正确的是( )
①常温下,0.01mol/L的硝酸AG为10 ②溶液的AG越大,碱性越强
③任何温度下,纯水的AG为零 ④250C时,某溶液的AG=-12,其PH为12
A. ①③ B. ②④ C. ①② D. ③④
10.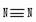 科学家已获得理论研究意义的N4分子,其结构与白磷分子相似,均为正四面体结构。已知断裂1molN-N键吸收193KJ的热量,断裂1mol 键吸收941KJ热量,则( )
科学家已获得理论研究意义的N4分子,其结构与白磷分子相似,均为正四面体结构。已知断裂1molN-N键吸收193KJ的热量,断裂1mol 键吸收941KJ热量,则( )
A.N4与N2属同分异构体 B.1molN4转化为2molN2需放出724KJ的能量
C.N4的熔点比白磷P4高 D. 1molN4转化为2molN2需吸收724KJ的能量
9.下列说法正确的是:( )
A.放热且熵减少的反应有可能自发进行 B.放热反应的焓变小于零,熵变一定大于零
C.熵变大于零的吸热反应不可能自发进行 D.放热及熵增的反应不可能自发进行
8.广泛使用的锌锰碱性电池以KOH溶液为电解质溶液,电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,下列说法正确的是( )
A.电池工作时,电子由正极通过外电路流向负极
B.电池正极反应式为:2MnO2+2H2O+2e- =2MnOOH+2OH-
C.外电路中每通过0.1mol电子,锌的质量理论上减少6.5g
D.电池工作时,OH-向正极方向移动
7.氨水与HBr混合得到一种无色透明的碱性溶液,该溶液中离子浓度关系不可能存在( )
A.C(NH4+)>C(Br-)>C(OH-)>C(H+) B. C(NH4+)>C(Br-)=C(OH-)>C(H+)
C. C(OH-)> C(Br-)= C(NH4+)>C(H+) D. C(NH4+)> C(OH-)>C(Br-)> C(H+)
6.已知0.1mol/L的NaHSO3溶液呈酸性,该溶液中有关微粒浓度的关系正确的是( )
a+)+C(H+)=C(HSO3-)+C(SO32-)+C(OH-) B. C(Na+)>C(HSO3-)>C(SO32-)>C(H+)>C(OH-)
C. C(Na+)+C(H+)<C(HSO3-)+C(SO32-)+C(OH-) D. C(Na+)=C(HSO3-)+C(SO32-)+C(H2SO3)
5.常温下,K2CO3和NH4I溶液的PH分别为10和5,两溶液水电离出来的C(H+)之比为( )
A.10:1 B.1:2 C.1:105 D.1:5
4.1L溶液中已电离的水是1×10-13mol,这样的溶液中肯定不能大量存在的离子组是( )
A.K+、Na+、NO3-、SO42- B.Mg2+、NO3-、Cl-、K+
C.Fe2+、NO3-、Cl-、Na+ D.Na+、SO42-、Cl-、NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com