
题目列表(包括答案和解析)
3.用某种玻璃仪器测量某液体的体积,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所使用的仪器可能是 ( )
A.量筒 B.酸式滴定管 C.量杯 D.容量瓶
2.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式:Cu-2e-=Cu2+
D.惰性电极电解饱和食盐水时,阳极的电极反应式:2Cl--2e-=Cl2↑
1.下列关于能源及能量转化的说法中不正确的是 ( )
A.现在使用的各种照明设备大部分属于将电能转化为光能的装置
B.燃料发生燃烧反应时,将燃料蕴藏的化学能只转化为热能
C.风能是太阳能的一种转换形式,风能可以再转化为电能
D.氢气是一种高效而没有污染的二级能源,常用作火箭和燃料电池的燃料
24.(11分)
Ⅰ.某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制成100mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): ;
②该滴定操作中应选用的指示剂是: ;
③在G操作中如何确定终点? 。
(2)若碱式滴定管用蒸馏水润洗后,未用标准液润洗,将导致滴定结果 (填“偏小”、“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 (计算结果保留小数点后二位)。
Ⅱ.滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更__ __(填“难”、“易”)溶的缘故。
班级 姓名 考号
22.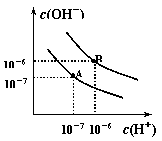 (9分).已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(9分).已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为 (填“A”或“B”),
请说明理由
(2)25时,将=9的NaOH溶液与=4的溶液混合,
若所得混合溶液的 =7,则NaOH溶液与溶液的体积比为
(3)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后
溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:
23(12分).右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH==2K2CO3+6H2O
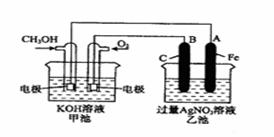
(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式: 通入O2的电极的电极反应式是 。A(Fe)电极的电极反应式为 ,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
21.(8分)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中
c(Na+) c(CH3COO-) 。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
20. 按图示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为
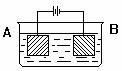
A. 4∶1 B. 3∶1 C. 2∶1 D.任意比
第II卷(非选择题 共40分)
19.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
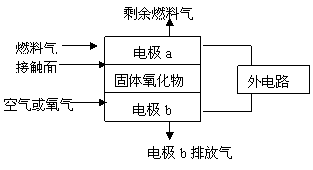
固体氧化物燃料电池的工作原理示意图
A.电极b为电池负极,电极反应式为O2+4e- ==2O2-
B.固体氧化物的作用是让电子在电池内部通过
C.若H2作为燃料气,接触面上发生的反应为: H2+2OH--2e-=2H2O
D.若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
18. 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下向
10mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
17.用Pt电极电解含有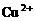 和
和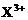 均为0.1 mol的溶液
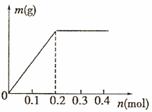
均为0.1 mol的溶液 ,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是
,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是
 A.
A.
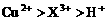
B. 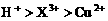
C. 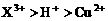
D. 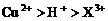
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com