
题目列表(包括答案和解析)
7.在一密闭容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.8倍,则( )
bB(g)达平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.8倍,则( )
A. 平衡向正反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
6.反应:A(g)+3B(g) 2C(g)(正反应为放热反应)达到平衡后,将气体混合物的温度降低,下列叙述正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率变大,平衡向逆反应方向移动
C.正反应速率和逆反应速率均变小,平衡向逆反应方向移动
D.正反应速率和逆反应速率均变小,平衡向正反应方向移动
5.下列事实不能用勒夏特列原理解释的是( )
A、由H2、I2蒸气、HI组成的平衡体系升温后颜色变深
B、工业合成氨使用催化剂来提高合成氨的反应速率
C、使用排饱和食盐水的方法收集氯气
D、氨水应密闭保存
4.实验室在配制三氯化铁溶液时,先把三氯化铁晶体溶解在浓盐酸溶液中,再加水稀释至所需浓度,如此操作的目的是( )
A.防止三氯化铁挥发 B.抑制三氯化铁水解
C.促进三氯化铁水解 D.提高三氯化铁的溶解度
3.下列水解离子方程式正确的是( )
A.NH4+
+ H2O 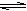 NH3·H2O
+ H+ B.Cl- + H2O
NH3·H2O
+ H+ B.Cl- + H2O 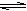 HCl+
OH-
HCl+
OH-
C.Fe3+
+ 3H2O 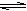 Fe (OH)3↓+ 3H+ D.CO32-
+ 2H2O
Fe (OH)3↓+ 3H+ D.CO32-
+ 2H2O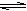 H2CO3 + 2OH-
H2CO3 + 2OH-
2.pH=1的H2SO4溶液中由水所电离出的c(H+)为 ( )
A. 0.1 mol / L B. 10-7 mol / L C. 10-14 mol / L D. 10-13 mol / L
1.以下是几位同学在学习了化学反应速率和化学平衡理论以后发表的一些看法,其中不正确的是( )
A、化学反应速率理论可指导怎样在一定时间内快出产品
B、化学平衡理论可指导怎样使用有限原料多出产品
C、化学反应速率理论可指导怎样提高原料的转化率
D、正确利用化学反应速率和化学平衡理论可提高化工生产的综合经济效益
21.(12分)某化学研究性学习小组的同学,为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。然后分别设计了如下几种实验方案。
同学甲:取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g
同学乙:取25.00 mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g[高&考%资(源#网]
同学丙:取25.00 mL上述溶液,用amol/L 的酸性KMnO4溶液进行滴定(5SO32-+2MnO4-
+6H+=5SO42-+2Mn2++3H2O),消耗KMnO4溶液b mL。
(1)写出Na2SO3固体氧化变质的化学方程式_________________________________。
(2)在丙同学的方案中滴定时是否需要选择指示剂?_____________ (填“需要”或“不需要”),滴定终点的颜色变化是_______________________________,操作中应该用_____式滴定管取用KMnO4溶液。此方案中,测得Na2SO3的纯度为__________________。
(3)由甲同学的方案测得的Na2SO3纯度为______________________;实验中发现,乙同学的方案测定的Na2SO3纯度比甲、丙两位同学的方案的结果都要低得多。试分析产生上述现象的原因
20.(8分)某同学设想使用下列试剂、仪器完成影响化学反应速率的外因探究: 试剂:5%的H2O2溶液,MnO2,FeCl3溶液,CaCO3(块状),CaCO3(粉未),1mol/L盐酸,0.1mol/L盐酸,热水、冷水仪器:试管,药匙,烧杯、镊子、托盘天平实验方案如下,请你完成空白部分
|
影响因素 |
所用试剂 |
预期现象 |
结论 |
|
温度 |
|
|
|
|
|
|
取等量CaCO3放入两支试管中,再分别加入1mL1mol/L盐酸,0.1mol/L盐酸 |
|
|
|
H2O2溶液、MnO2 |
|
|
|
|
|
|
粉未状的CaCO3产生气体快。固体表面积大反应速率快 |
19.(14分)由若干种可溶性物质组成的固体混合物X,可能含有的阳、阴离子分别是:
|
阳离子 |
Na+、Mg2+ 、Al3+、Ag+、Ba2+ |
|
阴离子 |
OH-、Cl-、SO42-、SO32-、CO32- |
为了鉴定其中的离子,现进行如下实验,试根据实验现象和要求填空。
(1)取少许该白色固体加水溶解,最后得到无色溶液;用pH试纸检测,溶液的pH为13。则X中一定不存在的离子是__________________。
(2)向溶液中滴加盐酸溶液。刚开始无沉淀,后有沉淀生成,继续滴加沉淀消失,并有无色无味气体逸出。则X中一定存在的离子是____________________,一定不存在的离子有____________________。
(3)若组成X的物质有三种,则可能是(用化学式表示,写出一组即可)____________。
(4)尚待检验的离子及检验方法是:
|
尚待检验的离子 |
检验方法 |
|
|
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com