
题目列表(包括答案和解析)
1.北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
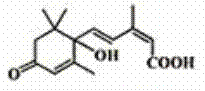 A.含有碳碳双键、羟基、羰基、羧基
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
21.(14分)Br2和Fe3+ 的水溶液浓度较小时均呈现黄色,二者都具有较强的氧化性。某化学兴趣小组拟通过探究实验来比较二者氧化性的强弱。
实验操作:向足量的硫酸亚铁溶液中加入少量浓溴水,振荡。
实验现象:溶液由浅绿色变为黄色。
(1)提出假设:
甲同学认为氧化性:Br2 >Fe3+ ,则反应的离子方程式为 ;
乙同学认为氧化性:Fe3+ >Br2 ,则使溶液呈黄色的物质是 (填化学式)。
(2)通过进一步实验可以检验甲和乙的结论谁对谁错,下列是设计的一些实验方案和预测:
|
方案 |
实验操作 |
预期现象及结论 |
|
1 |
取少量黄色溶液,加入NaOH溶液 |
若生成红褐色沉淀,则甲正确 |
|
2 |
取少量黄色溶液,加入淀粉KI溶液 |
若溶液变蓝色,则乙正确 |
|
3 |
取少量黄色溶液,加入苯溶液,振荡后静置 |
若上层溶液呈橙红色,则 正确 |
①方案1是否合理 (填“是”或“否”)。
②方案2中,由于存在反应 (用离子方程式表示),
所以预测结论不正确。
③请另外设计一个合理方案,证明已经发生反应。将有关内容填入下表。
|
实验操作 |
预期现象及结论 |
|
|
|
亳州市2010-2011学年度第一学期高二期末考试
20.(12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:
N2O4
 2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)(mol) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)(mol) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)在20s - 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
19.(9分)用中和滴定法测定烧碱的纯度,已知烧碱中杂质不与酸反应,试根据要求填空:
(1)配置待测液:称取5.0g烧碱样品,配成250mL待测溶液;
(2)滴定:用0.2000 mol·L-1标准盐酸溶液滴定待测溶液,下面的操作错误的有 。
①用标准盐酸溶液润洗酸式滴定管;
②用待测烧碱溶液润洗锥形瓶;
③两个同学合作,一人控制酸式滴定管的活塞,另一人摇动锥形瓶;
④滴定过程中,操作者的眼睛始终注视酸式滴定管液面的变化。
(3)根据下表数据计算:①待测烧碱溶液的物质的量浓度: (结果保留 4位有效数字); ②烧碱的纯度: 。
|
滴定次数 |
待测溶液 体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.45 |
|
第二次 |
10.00 |
4.00 |
24.05 |
18.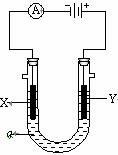 (8分)右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,
(8分)右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,
X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
(1)X电极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y电极上的电极反应式为 ,
若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为 g 。
17.(6分)(1)已知天然气和水蒸气反应的热化学方程式为:CH4(g) + H2O(g)  CO(g)+ 3H2(g) ΔH = +206.4kJ·mol-1,则制得56g CO需要吸收的热量为 kJ;
CO(g)+ 3H2(g) ΔH = +206.4kJ·mol-1,则制得56g CO需要吸收的热量为 kJ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g) CO2(g)+H2(g)
ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =
kJ·mol-1。
CO2(g)+H2(g)
ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =
kJ·mol-1。
16.(6分)写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
15.一定温度下,在容积不变的密闭容器中发生反应:2NO2(g) 2NO(g)+ O2(g),能说
2NO(g)+ O2(g),能说
明该反应已达化学平衡状态的是( )
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③容器内气体的压强不再改变
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
A. ①②④ B. ②③⑤ C. ①③④ D. ①②③④⑤
第Ⅱ卷 (非选择题 共55分)
14.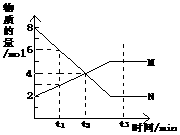 在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如右图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如右图,下列表述中正确的是( )
A.反应的化学方程式为:2M  N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
13.下列离子方程式中正确的是( )
A.鸡蛋壳在醋酸中溶解:CO32-+ 2CH3COOH
 2CH3COO- + CO2↑+ H2O
2CH3COO- + CO2↑+ H2O
B.Na2CO3溶液使酚酞变红:CO32- + H2O  HCO3- + OH-
HCO3- + OH-
C.向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2+ +
SO42- BaSO4↓
BaSO4↓
D.向NaHCO3溶液中加入稀盐酸溶液:CO32-
+ 2H+ H2O + CO2↑
H2O + CO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com