
题目列表(包括答案和解析)
5.25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是( )
A.该溶液的pH一定是9 B.该溶液的pH一定是5
C.该溶液不可能显中性 D.不会有这样的溶液
4.pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则c(H+)或c(OH-)的变化( )
A.c(H+)和c(OH-)都减少 B.c(H+)减小c(OH-)增大
C.c(OH-)减小c(H+)增大 D.c(H+)和c(OH-)都增大
3.室温下,等物质的量浓度的下列溶液中,水电离程度由强到弱的顺序是( )
①NH4Cl ②NaCl ③KNO3 ④NaOH
A.①>④>②=③ B.④>②=①>③ C.②>③>①>④ D.①>②=③>④
2.分别将足量的碳酸钠溶液加到pH、体积都相同的醋酸和盐酸中,在相同的条件下,放出二氧化碳气体的体积最多的是( )
A.醋酸 B.盐酸 C.一样多 D.无法比较
1.下列物质溶于水中,存在电离平衡(除水外)的是( )
A.NaOH B.Na2CO3 C.H2SO4 D.CH3COOH
21.(12分)
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式: 。
乙同学类比加热Ca(HCO3)2溶液,会出现 现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断水解程度:
Na2CO3 NaHCO3(填“大于”或“小于”)
丙同学认为甲、乙的判断都不充分。丙认为:
⑴ 只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明 (填“甲”或“乙”)判断正确。
试剂X是______________(填字母)
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵ 将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则说明另一判断正确。
20. (12分)
已知2NO2(g) N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如右图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题:
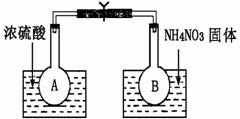 (1)观察到的实验现象为:
(1)观察到的实验现象为:
(2)由实验现象可知,升高温度,该化学
平衡向 (填“正”或“逆”)反应方向移动,
反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ. 在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(1) 某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气
体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:
。
(2) 某同学将第三支针筒活塞迅速拉至20mL处。
① 该同学观察到的现象是:
② 在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
19.(12分)下表是不同温度下水的离子积数据:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积 (mol2·L-2 ) |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a 1×10-14 (填“>”、“<”或“=”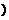 ,作此判断的理由是 。
,作此判断的理由是 。
(2)25℃下,某Na2SO4溶液中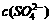 = 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)=
。
= 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)=
。
(3)在t2 ℃下,pH = 10的NaOH溶液中,水电离产生的OH-浓度为
c(OH-)水= 。
(4)t2 ℃下,将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH = 2,则V1∶V2 = ,
此溶液中各种离子的浓度由大到小的排列顺序:
。
18. (14分) 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ,
② ,
③ 。
(2)溶液中共有___________种粒子(指分子和离子)
(3)在这些粒子中,浓度是0.01 mol·L-1的是 ,
浓度是0.002 mol·L-1的是 。
(4)___________和___________物质的量之和等于0.01mol。
17. (10分)电化学与生产生活密切相关。
(10分)电化学与生产生活密切相关。
(1)右图是一个电化学装置示意图。
①如果A为含有锌、银、金等杂质的粗铜,B为纯铜,C为
CuSO4通电一段时间后,A极减少的质量将 B极增加
的质量(填“等于”、“大于”或“小于”)。
②如果A是铂电极,B是石墨电极,C是氯化钠溶液,用氢氧燃料电池做电源,制得11.2L(标准状况)Cl2时,该燃料电池理论上需消耗 H 2的物质的量为 mol。
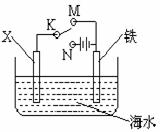 (2)利用下图装置模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于
处(填M或N);
(2)利用下图装置模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于
处(填M或N);
若X为锌,开关K置于M处,该电化学防护法称为:
。
(3)工业上采用电解的方法来制取活泼金属铝。
写出电解反应方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com