
题目列表(包括答案和解析)
17.(8分) 按要求完成下列化学用语:
(1) 硫化钠溶液显碱性的离子方程式:________________________________
(2) 氯化铝溶液与碳酸氢钠溶液混合的离子方程式
____________________________________________________________
(3) 碳酸显酸性的电离方程式:________________________________________
(4) (NH4)2SO4溶液呈酸性的离子方程式:__________________________________
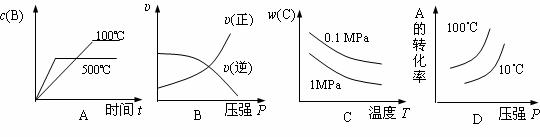
16.在一个固定体积的密闭容器中,加入2 molA和1 molB发生如下反应:2A(g)+B(g)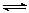 3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2
mol/L的是
3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2
mol/L的是
A.4 mol A+2 mol B
B.3 mol C+1 mol D+l mol B
C.3 mol C+0.8 mol D
D.1.6 mol A+0.8 mol B+0.6 mol C+0.3 mol D
第Ⅱ卷(非选择题 共60分)
15.对于可逆反应:2A(g)+B(g)  2C(g)(正反应是放热反应);下列各图中正确的是
2C(g)(正反应是放热反应);下列各图中正确的是
( )
14.在相同条件下(温度为227℃),有相同体积的甲和乙两容器,甲容器充入1 mol SO2和1 mol O2,乙容器中充入2 mol SO2和2 mol O2。下列叙述错误的是( )
A.化学反应速率:乙>甲 B.平衡后O2的浓度:乙>甲
C.SO2转化率:乙>甲 D.平衡后SO2的体积分数:乙>甲
13.可逆反应:2NO2 2NO+O2
在密闭容器中反应,达到平衡状态的标志是: ( )
2NO+O2
在密闭容器中反应,达到平衡状态的标志是: ( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
12. 0.1mol/L的NaOH溶液和0.1mol/LNH4Cl溶液,等体积混合后,离子浓度不正确的是( )
a+)=c(Cl-)>c(OH-)>c(H+) a+)+c(H+)+c(NH4+)=c(Cl-)+c(OH-)
a+)=c(Cl-)>c(H+)>c(OH-) D. c(H+)+c(NH4+)=c(OH-)
11.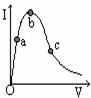 一定温度下,冰醋酸加水稀释的过程中,溶液导电能力(I)随加水的体积(V)变化如图所示,下列说法不正确的是
( )
一定温度下,冰醋酸加水稀释的过程中,溶液导电能力(I)随加水的体积(V)变化如图所示,下列说法不正确的是
( )
A.“O”点导电能力为0的理由是无水,冰醋酸没有电离出
自由移动离子
B. a、b、c三点中,溶液中CH3COOH的电离程度由小到大的
顺序是:c﹤b﹤a
C.a、b、c三点中,氢离子浓度由小到大的顺序是:c﹤a﹤b
D.若使b点处溶液中c(H+)减小,可向溶液中加水或加冰醋酸
10.PH=2的醋酸溶液100 ml和PH=13的NaOH溶液10 ml等体积混合,则混合溶液的PH为( )
A. PH=7 B. PH> 7 C. PH<7 D.无法确定
9.用食用白醋(醋酸浓度约为0.1 mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
(A)白醋中滴入石蕊试液呈红色
(B)同样的锌粒分别和pH相等的白醋和盐酸反应,开始时速率相等。
(C)蛋壳浸泡在白醋中有气体放出
(D)pH试纸显示醋酸的pH约为3
8.常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)·c(OH-)=10-24。该溶液中一定能够大量存在的离子组是( )
A.K+、Na+、Cl-、NO3- B.Al3+、Na+、CO32-、Br-
C.NH4+、K+、HCO3-、SO42- D.Na+、K+、NO3-、SO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com