
题目列表(包括答案和解析)
9、2SO2(g)+O2(g) 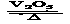 2SO3(g)是制备硫酸的重要反应。下列叙述正确的
2SO3(g)是制备硫酸的重要反应。下列叙述正确的
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大容器体积,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为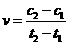
8、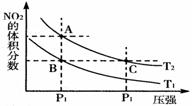 反应N2O4(g)
反应N2O4(g) 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(
)
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(
)
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
7、下列说法正确的是 ( )
A.在101 kPa、25 ℃时,中和热为57.3 kJ/mol,则表示Ba(OH)2的稀溶液与足量稀硫酸反应的热化学方程式为:
Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O (l) ΔH=-114.6 kJ/mol
B.在101 kPa、25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量;则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ/mol
C.pH=11的氨水和pH=3的盐酸等体积混合,由于NH4Cl水解而使溶液呈酸性
D.在相同情况下,强电解质溶液的导电性比相同浓度弱电解质溶液的导电性强
6、下列方程式书写正确的是( )
A. CO32-的水解方程式:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B. H2SO3的电离方程式H2SO3 2H++SO32-
2H++SO32-
C. HCO3- 在水溶液中的电离方程式:HCO3-+H2O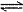 H3O++CO32-
H3O++CO32-
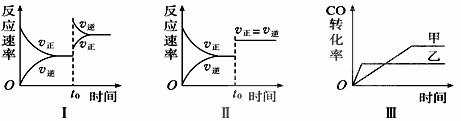
D. CaCO3的电离方程式:CaCO3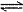 Ca2++CO32-
Ca2++CO32-
5、 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g) =Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1 (Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应
4、 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g)
ΔH<0,下列对图像的分析中不正确的是( )
CO2(g)+H2(g)
ΔH<0,下列对图像的分析中不正确的是( )
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
3、已知:(1)Zn(s)+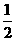 O2(g)=== ZnO(s),ΔH1=
-348.3 kJ·mol-1,
O2(g)=== ZnO(s),ΔH1=
-348.3 kJ·mol-1,
(2)2Ag(s)+ 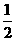 O2(g)=== Ag2O(s),ΔH2=-31.0 kJ·mol-1,
O2(g)=== Ag2O(s),ΔH2=-31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
2、 已知肼(N2H4)的燃烧热是534 kJ·mol-1,当它氧化生成1g水时,反应放出的热约为
A.29.7 kJ B.14.8 kJ C.-29.7 kJ/mol D.-14.8kJ/mol
1、 已知:CH3COOH(aq)+ NaOH(aq)= CH3COONa(aq)+ H2O(1) △H=-Q1kJ/mol
1/2 H2SO4(浓)+ NaOH(aq)=1/2 Na2SO4(aq) + H2O(1) △H=-Q2kJ/mol
HNO3(aq) + KOH(aq)= KNO3(aq) + H2O(1) △H=-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系为( )
A. Q2=Q3 > Q1 B.Q2 > Q1 > Q3 C.Q2 > Q3 > Q1 D.Q3 > Q2 > Q1
19.⑴(8分)① ② ⑵(6分)① ②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com