
题目列表(包括答案和解析)
2.下列说法不正确的是
A.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大
B.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
C.属于放热和熵增加的反应,就更易自发进行
D.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小
1.2010年上海世博会的主题是“城市,让生活更美好”。下列有关说法错误的是
A.世博停车场安装催化光解设施,将汽车尾气中CO和NOx反应生成无毒气体
B.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
C.倡导人们使用乙醇汽油作为汽车燃料可真正实现二氧化碳零排放
D.世博会期间用“玉米塑料”餐盒替代传统塑料餐盒,是为了防止带来白色污染
23.(6分)常温时,将0.05mol/l的盐酸和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得溶液pH值为12,用上述氢氧化钠溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时,消耗氢氧化钠溶液12.5ml,试求:
(1)氢氧化钠溶液的物质的量浓度?
(2)此一元弱酸的电离度?
22.(15分)以下是元素周期表的一部分,根据给定的元素回答下列问题
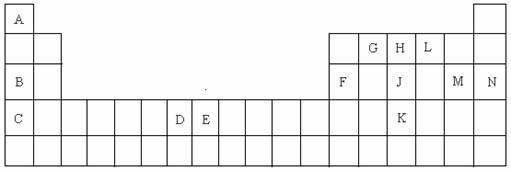
(1)K的元素符号是 ;
(2)D元素的外围电子排布图是 ,在其化合物中,最高正价是 ;
(3)C元素的原子结构示意图是 ;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是 分子(填极性或非极性),B与L(1:1)的化合物的电子式是 ;
(5)G、H、L原子的第一电离能由高到低的顺序是 (填元素符号);
(6)J单质的一种白色同分异构体的空间构型是 ;
(7)E元素在元素周期表中的位置是 ,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是 ;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是 ;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式 ;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
19.(6分)(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则甲烷燃烧的热化学方程式为_________________________。
(2)能证明甲烷是正四面体结构的理由是
①中心原子C采取sp3杂化,②中心原子C上没有孤对电子,
③CH2Cl2不存在同分异构体,④键角是109028,,而不是900
(7分)用实验确定某酸HA是弱电解质。两同学的方案是: 甲:①称取一定质量的HA配制0.l mo1·L-1的溶液100mL; ②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。 乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL; ②分别取这两种溶液各10mL,加水稀释为100mL; ③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。 (1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是 (多选扣分) (a)装HCl溶液的试管中放出H2的速率快; (b)装HA溶液的试管中放出H2的速率快; (c)两个试管中产生气体速率一样快。 (3)请你评价:乙方案中,难以实现之处是配制100mLpH=l的HA溶液;而不妥之处是
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
21 (10分) 向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3--t4阶段为使用催化剂。观察下图,回答下列问题:
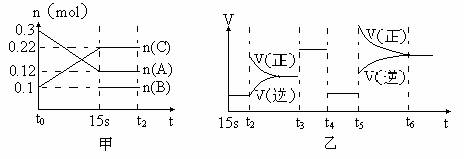
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
18.(5分)在原子结构理论中,有四个原理,分别是①构造原理,②泡利原理,③洪特规则,④能量最低原理。在以下的现象中主要决定的因素是(填序号,各只填一项)
(1)各能级最多容纳的电子数是该能级原子轨道数的2倍 ;
(2)碳原子的核外电子排布基态时是1s22s22p2而不是1s22s12p3 ;
(3)最外层电子数不会超过8个,次外层电子数不会超过18个 ;
(4)铬(24Cr)的电子排布式是1s22s22p63s23p63d54s1而不是1s22s22p63s23p63d44s2 ;
(5)磷原子的基态原子结构中,有3个未成对的单电子 。
17.25℃、101 kPa下,碳、氢气、乙烯和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、1411.0kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO(g) △H= -393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H=+571.6 kJ/mol
C.C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=-1411.0 kJ/mol
D. 1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) △H= -1 400 kJ/mol
第Ⅱ卷(49分)
16.下列离子方程式书写正确的是( )
A.次氯酸钙溶液中通入过量的二氧化碳:
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加入过氧化氢溶液:
2Fe2++H2O2+2H+=2Fe3++2H2O
C.用氨水与少量的二氧化硫反应:
NH3·H2O+SO2=NH4++HSO3-
D.硫酸锌溶液中加过量氨水:
Zn2++2 NH3·H2O=Zn(OH)2↓+2NH4+
15.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡: Cu2+
+SO42-+x H2O  CuSO4·xH2O,当向硫酸铜溶液(析有硫酸铜晶体)中加少量无水硫酸铜粉末后,下列说法中正确的是(
)
A.溶液中Cu2+浓度增大
B.溶液中Cu2+数目不变
C.硫酸铜晶体体积增大
D.溶液的蓝色变浅
CuSO4·xH2O,当向硫酸铜溶液(析有硫酸铜晶体)中加少量无水硫酸铜粉末后,下列说法中正确的是(
)
A.溶液中Cu2+浓度增大
B.溶液中Cu2+数目不变
C.硫酸铜晶体体积增大
D.溶液的蓝色变浅
14. 反应3H2(g)
+ N2(g) 2NH3(g)
ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
2NH3(g)
ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
A.随温度升高K增加 B.随压强升高K增加
C.随温度升高K减小 D.随压强升高K减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com