
题目列表(包括答案和解析)
4.现有下列物质:①纤维素、②甲酸甲酯(HCOOCH3)、③淀粉、④乙酸,其中符合Cn(H2O)m的组成且不属于糖类的是
A.①④ B.②④ C.①③ D.②③
3.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是
A.Na2O和SiO2熔化 B.Mg和S熔化
C.氯化钠和蔗糖熔化 D.碘和干冰升华
2.1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断中不正确的是
A.原子晶体干冰有很高的熔点、沸点,有很大的硬度
B.原子晶体干冰易气化,可用作制冷材料
C.原子晶体干冰的硬度大,可用作耐磨材料
D.每摩尔原子晶体干冰中含4mol C-O键
1.某广告称某种品牌的八宝粥不加糖,比加糖还甜,适合糖尿病人食用。你认为下列关于糖尿病人能否食用此八宝粥的判断中,错误的是
A.这个广告中有误导喜爱甜食消费者的嫌疑,不甜不等于没有糖
B.糖尿病人应少吃含糖的食品,该八宝粥未加糖,可以放心食用
C.不加糖不等于没有糖,糖尿病人需慎重
D.不能听从厂商或广告商的宣传,应询问医生
21.水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示:
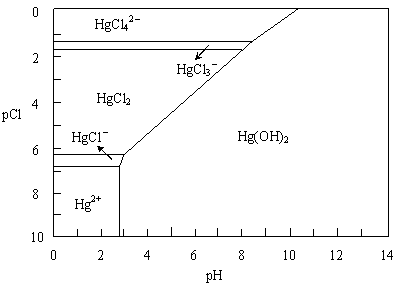 [注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]。
[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]。
⑴正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
⑵Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是 。
⑶处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知:
Ksp(HgS) =1.6×10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= 。
③用难溶的FeS作为沉淀剂也可使Hg2+转化为HgS而除去,该反应的离子方程式:
。有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请运用所学知识解释
江苏省泰州中学2010-2011年度第二学期
20.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
⑴不考虑其它组的实验结果,只从甲组情况分析,
若a 7(填>、<或=),则HA为强酸;若a 7(填>、<或=),则HA为弱酸。
⑵在乙组中混合溶液中离子浓度(A-)与(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
⑶从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是 。
⑷丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
19.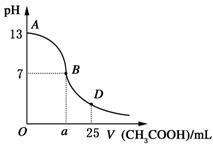 I.右图为向25mL 0.1 mol·L-1
NaOH溶液中逐滴滴加0.2
mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
I.右图为向25mL 0.1 mol·L-1
NaOH溶液中逐滴滴加0.2
mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
⑴B点溶液呈中性,此时a 12.5
(填“>”、“<”或“=”)。有人据此认为,在
B点时NaOH与CH3COOH恰好完全中和,这种
看法是否正确? (选填“是”或“否”)。
若不正确,则二者恰好完全中和的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
⑵关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
|
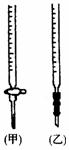
滴定终点时的现象为:
⑶AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
⑷在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
II.酸碱中和滴定实验是中学阶段重要的定量实验之一。根据所学内容,试回答下列问题:
⑸滴定管精确度较高,可读至 mL。准确量取KMnO4溶液可用 式滴定管。
⑹滴定时其余操作均准确,若用待测液润洗锥形瓶,则测得待测液的浓度 (填偏高、偏低、不变。下同);若盛放标准液的滴定管下端有气泡,且在滴定过程中排出,则测得待测液的浓度
18.⑴在温度t℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L,则该温度下水的离子积Kw= ,t 25 ℃(填“>”、“<”或“=”),在此温度下pH均为4的硫酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为______________________。
该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
⑵将标准状况下的4.48 L氨气完全溶解在含0.05 mol H2SO4的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序 。无论氨水与硫酸以何种比例混合,溶液中始终存在的等量关系是c(NH4+)+c(H+)= 。
⑶常温下,pH=10的强碱AOH和1×10-4 mol/L的三元酸H3B等体积混合后溶液显酸性,生成盐的化学式为 。若AOH与H3B完全中和所得正盐溶液呈碱性,其原因用离子方程式表示为 。
17.今有①CH3COOH、②HCl、③H2SO4 三种溶液,试回答下列问题
⑴当它们的物质的量浓度相同时,其pH的由大到小排列是 (用序号回答)
⑵当它们pH相同时,其物质的量浓度的由大到小排列是 (用序号回答)
⑶中和同一烧碱溶液,需同浓度的三种酸溶液的体积依次为:V1、V2、V3,它们的关系为 。(用只含“=”的关系式表示)
16.下列关于氯水和氨水的说法中正确的是:
A.氨水中存在3种分子,分别是: H2O、NH3 、NH3·H2O
B.等体积、等浓度的氨水和醋酸溶液混合所得溶液呈中性,说明CH3COONH4不水解
C.氯水中存在3种离子,分别是:H+、Cl―、OH―
D.在饱和氯水中加入CaCO3,可以得到浓度较大的次氯酸
第Ⅱ卷(非选择题 共64分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com