
题目列表(包括答案和解析)
4.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀速度最慢的是( )
A. 在含铁元素较多的酸性土壤中
B. 在潮湿输送透气的土壤中
C. 在干燥致密不透气的土壤中
D. 在含碳粒较多,潮湿透气的土壤中
3.某原电池,将两金属X、Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则可能是下列情况中的( )
A. X是负极,电解质溶液为CuSO4溶液
B. X是负极,电解质溶液为稀H2SO4溶液
C. X是正极,电解质溶液为CuSO4溶液
D. X是正极,电解质溶液为稀H2SO4溶液
2. 下列各反应中,属于原电池反应的是( )
A.氧化铝膜破坏后,金属铝被迅速氧化
B.白铁镀锌层破损后,还能阻止铁被氧化
C.红热的铁与水接触表面上形成蓝黑色的保护层
D.铁丝在氯气中燃烧产生大量棕黄色的烟
1. 下列说法中正确的是( )
A.原电池是把电能转化为化学能的装置
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化还原反应
D.原电池中的阳离子向正极移动
3.(1)2I– –2e–== I2 (2) 2H+ +2e-- == H2↑(3)KI(或NaI)等水溶液 (4)CCl4 (5)碘在CCl4中的溶解度大于在水中的溶解度,所以绝大部分碘都转移到CCl4中。(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色[若(3)中用NaI,此处火焰为黄色]
1.
 D 2.(1)阳极:Fe –2e– == Fe2+ 阴极:2H+ +2e– == H2↑(2)Cr2O72–
+6 Fe2+ +14H+ == 2Cr3+ + 6 Fe3+
+7 H2O(3)H+不断放电,且Cr2O72-与Fe2+ 反应消耗H+,打破了水的电离平衡,使溶液中的[H+]〈[OH--] (4)不能,用石墨做电极,阳极产生氯气或氧气,得不到还原剂Fe2+ ,缺少还原剂不能使Cr2O72– Cr3+
Cr(OH)3而除去
D 2.(1)阳极:Fe –2e– == Fe2+ 阴极:2H+ +2e– == H2↑(2)Cr2O72–
+6 Fe2+ +14H+ == 2Cr3+ + 6 Fe3+
+7 H2O(3)H+不断放电,且Cr2O72-与Fe2+ 反应消耗H+,打破了水的电离平衡,使溶液中的[H+]〈[OH--] (4)不能,用石墨做电极,阳极产生氯气或氧气,得不到还原剂Fe2+ ,缺少还原剂不能使Cr2O72– Cr3+
Cr(OH)3而除去
15.(1)还原 2Cu2+ + 4e–== 2Cu (2)氧化 4OH––4e– == 2H2O + O2↑ (3)6.4g 1.12L 1 (4)12.8 不变
拓展提高
1.C 2.C 3.D 4.B 5.B 6.D 7.A 8.C 9.D 10.B 11.B 12.B 13.C 14.(1)HCl、CuCl2 (2)H2SO4 (3)NaCl、CuSO4
3.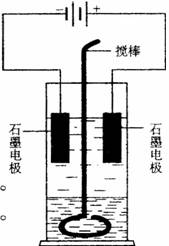 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为______________________________。
(2)阴极上的电极反应式为______________________________。
(3)原上层液体是______________________________________。
(4)原下层液体是_____________________________________。
(5)搅拌后两层液体颜色发生变化的原因是________________________。
(6)要检验上层液体中含有的金属离子,其方法是_________________________。现象是___________________。
w。w-w*k&s%5¥u
第2节 电能转化为化学能-----电解
基础训练
2.工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量已低于排放标准。请回答下列问题:
(1)两极发生反应的电极反应式:
阳极____________________________,阴极___________________________________。
(2)写出Cr2O72-变为Cr3+的离子方程式:___________________________________。
(3)工业废水中有酸性变为碱性的原因是:__________________________________。
(4)________(填“能”或“不能”)改用石墨电极,原因是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com