
5.下列方程式中通入的气体只作氧化剂的是 ( )
A.氯气通入澄清石灰水 B.氧气通入氯化亚铁溶液
C.二氧化硫通入氢氧化钠溶液 D.氨氯通入溴水中
4.下列现象或事实均能用氧化还原反应的原理解释的是 ( )
A.苯酚溶液和FeCl2溶液长期暴露在空气中会变色
B.降温和活性炭使NO2气体颜色变浅
C.在BaCl2溶液中通SO2后加入H2O2或者NaOH溶液出现白色沉淀
D.HCl加入大理石或者Zn都有气泡生成
0.25NA
D.1L浓度为1mol·L-1的Na2s溶液中离子总数等于3NA
3.用NA表示阿伏加德罗常数的值。下列叙述错误的是 ( )
A.常温常压下,2.8g的乙烯与丁烯混合物具有的原子数为0.6NA
B.标准状况下,22.4L CO2与N2O混合物中所含有的电子数为22NA
C.稀硝酸与Fe反应的还原产物为NO,若消耗1mol HNO3,则被还原的氮原子数为
2.下列化学方程式或离子方程式正确的是 ( )
A.往碳酸镁中滴加稀盐酸: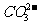 +2H+ == CO2↑+H2O
+2H+ == CO2↑+H2O
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- == CaSO3↓+2HClO
C.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2 == Fe3++Br2+4Cl-
D.溴乙烷在NaOH醇溶液中发生消去反应:
CH3CH2Br+NaOH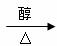 CH2
= CH2↑+NaBr+H2O
CH2
= CH2↑+NaBr+H2O
1.化学与生活、社会密切相关。下列说法不正确的是 ( )
A.煤炭、潮汐能、液化石油气分别属于化石能源、可再生能源和二次能源
B.CO2、Na2O2、CH3COOH分别属于非电解质、强电解质、弱电解质
C.石炭酸、熟石灰、生石灰分别属于酸、碱、盐
D.Cu、Fe、Al可以分别用置换法,热还原法和电解法冶炼得到
21.(10分)某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
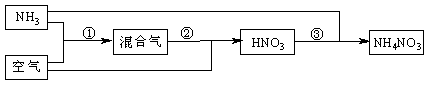
其中反应①为4NH3+5O2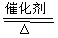 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨
(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
20.(8分)有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) 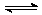 xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:(1)甲平衡时A的体积分数为 ;
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”)。
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)平= 。
(4)若x=4,则W% 40% (填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A) 甲中的c(A)。
19.(8分)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)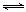 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
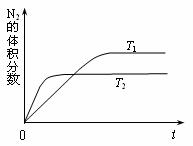
(1)下图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)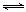 2NO(g)为 (填“吸热”或“放热”)反应。
2NO(g)为 (填“吸热”或“放热”)反应。
(2)2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K= 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
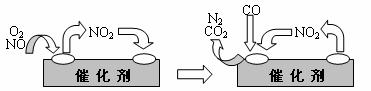
写出上述变化中的总化学反应方程式: 。
18.(12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
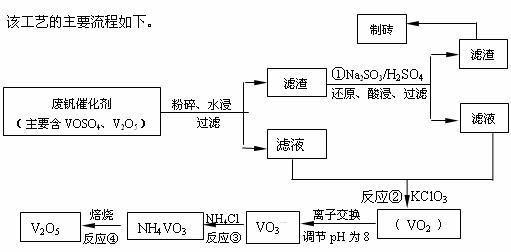
请回答下列问题:
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。
。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示。则NH4VO3在分解过程中 。
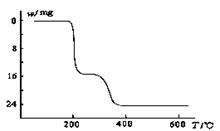
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com