
7.100mL2mol/L的盐酸跟过量的锌片反应,为加快反应速率,同时还不影响生成氢气的量,下列措施可行的是 ( )
A.加入适量的6mol/L的盐酸 B.加入数滴CuSO4溶液
C.加入适量的蒸馏水 D.加入适量氯化钠
6、已知25℃ 101KP下,石墨、金刚石的燃烧热化学方程式分别为:
C(石墨)+O2(g)==CO2(g) △H=-393.51KJ/mol
C(金刚石)+O2(g)==CO2(g) △H=-395.41KJ/mol
据此判断,下列说法正确的是 ( )
A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高
5.不能作为判断反应2NO+O2 2NO2达到平衡的标志的是 ( )
2NO2达到平衡的标志的是 ( )
A.NO、O2、NO2分子数目比为2:1:2
B.反应混合物中各组分的物质的量浓度不再变化
C.混合气体的颜色不再发生变化
D.混合气体的平均相对分子质量不再发生变化
4.下列关于△H(焓变)的说法正确的是 ( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.△H<0时,反应吸收热量:△H>0时,反应放出热量
C.热化学方程式中△H的数值与热化学方程式中的计量数有关
D.△H的值不可以通过实验测得
3.热化学方程式中的计量数表示的意义是 ( )
A.分子的个数 B.原子的个数 C.物质的量 D.物质的质量
2.吸热反应一定是 ( )
A.非自发的化学反应 B.释放能量
C.储存能量 D.反应需要加热
1.下列说法中正确的是 ( )
A.原电池是把电能转变为化学能的装置
B.原电池中电子流出的一极是正极,该极发生氧化反应
C.原电池的两极均发生氧化--还原反应
D.原电池工作时,阳离子向正极移动
28.(9分)用KMnO4晶体和浓盐酸制取氧气和氯气。取0.2molKMnO4晶体先加热制得一定量的氧气后停止加热,再将残留物与过量浓盐酸混合、加热,得到Cl2,此时溶液中的主要离子是K+、Mn2+、H+、Cl-。计算:
(1)KMnO4晶体完全分解时制得的氧气在标准状况下的体积。
(2)将(1)中完全分解的固体产物与过量的浓盐酸反应,可制得Cl2的物质的量。
(3)若最后得到的Cl2为0.48mol,则KMnO4制氧气时的分解率。
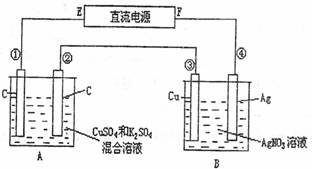
27.(4分)如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池原混合溶液中Cu2+的浓度。
26.(7分)在测定硫酸铜晶体中结晶水的含量的实验操作中:
(1)加热前晶体应该放在 中研碎,加热时是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失水的方法是 。
(3)做此实验时,最少应该进行称量操作 次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体的总质量 |
测得晶体中结晶水个数 |
|
11.7g |
22.7g |
18.6g |
|
(5)这次实验中产生误差的原因可能是 (填选项)
A.硫酸铜晶体中含有不挥发的杂质B.实验前晶体表面有水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com