
11.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.23gNa在氧气中完全燃烧失电子数为0.5NA
B.1L2mol·L-1的MgCl2溶液中含Mg2+数为2NA
C.标准状况下,11.2LSO3所含分子数为0.5NA
D.室温下,8g甲烷含有共价键数为2NA
10.下列实验装置图正确的是 ( )

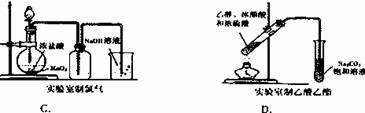
9.化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是 ( )
① 制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
② 在气体发生装置上直接点燃一氧化碳气体时,必需要先检验一氧化碳气体的纯度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声。
③ 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
④ 给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人
|
⑥ 配制浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A.①② B.③⑤ C.②③ D.②⑥
8.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是 ( )
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
7.食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是 ( )
A.淀粉的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.甲醛的含量
29.(12分) 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。 “速力菲”是市场上一种常见的补铁药物,下表格是它的说明书。
|
[规格] 每片含琥珀酸亚铁0.1g [适应症] 用于缺铁性贫血症,预防及治疗用。 [用量用法] 成人预防量0.1g/日,成人治疗量0.2g-0.4g/日, 小儿用量预防量30-60mg/日,治疗量0.1g-0.3g/日。 [儲藏] 避光、密封、在干燥处保存 |
(1)该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用。
①为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 ___________ ( 填试剂的名称 )
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应)。请配平下列离子方程式
_____MnO4- + _____Fe2+ + ______H+ = _____Mn2+ + ______Fe3+ + ______H2O
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00 g,将其全部溶于稀硫酸中,配制成1000.00 mL溶液,取出20.00 mL,用0.01 mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00 mL。该药品可以服用吗?______________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)_______ 。
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含23.6 g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式) ,
琥珀酸亚铁的化学式为 。
28.(18分)碱存在下,卤代烃与醇反应生成醚(R-O-R‘):
R-X+R‘OH R-O-R‘+HX
R-O-R‘+HX
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
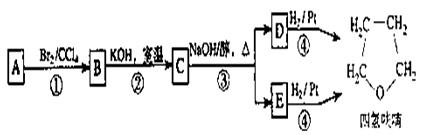
请回答下列问题:
(1)1 molA和1 molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%, 则Y的分子式为______________ A的结构简式为____________。
(2)第①②步反应类型分别为 ①
②
(3)化合物B具有的化学性质(填写字母代号)是__________________________
a.可发生氧化反应
b.强酸或强碱条件下均可发生消去反应
c.可发生酯化反应
c.催化条件下可发生加聚反应
(4)写出D和E的结构简式:
D_______________________ _______,
,
E_____ ______________________________,
。
(5)写出化合物C与 水溶液共热的化学反应方程式:
水溶液共热的化学反应方程式:
,
,
,
。
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
,
,
,
。
27.(15分)如下图所示的各物质的相互转变中,反应①、②是重要的工业反应,A的相对分子质量为120。X被人体吸入会与血红蛋白结合而使人中毒,Y会造成温室效应,D会形成酸雨,E是常见的金属,F分子的结构与Y分子的结构相似,且F的相对分子质量为60。
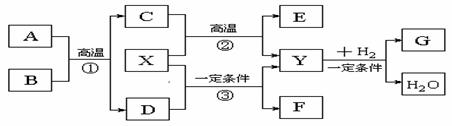
回答下列问题:
(1)反应①的化学方程式为: 。
(2)反应②的化学方程式为: 。
(3)写出F的结构式: 。
(4)Y与H2在一定条件下可生成多种物质,既可获得经济效益,也可减轻对环境的污染。
①若G是一种燃料,其相对分子质量与B的相对分子质量相等,则G的分子式为: 。
②若G是Y与H2按1∶3的比例反应而得,则G可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
第Ⅱ卷 本卷共10题,共174分。
26.(15分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1)写出化学式:A___________ B___________ D_________
(2)E溶液呈酸性的原因是:(用离子方程式表示)_______________________________
(3)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4)在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
13.X、Y是周期表前二十号元素 ,已知X、Y之间原子序数相差3 ,X、Y能形成化合物M。下列说法正确的是 ( )
A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种
D.若M属于离子晶体,则其中可能含有非极性键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com