
19.(共5分)
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g) p C(g)+q D(g)。
p C(g)+q D(g)。
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质_______mol 。
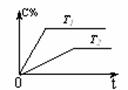
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如下图所示。则T1(填“>”、“<”或“=”)________T2,该反应的正反应的△H(填“>”、“<”或“=”)_________0。
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如下图所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
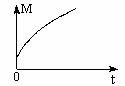
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”) 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
18.(共6分)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
17.(共10分)
元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
|
A |
|
|
|||||||||||||||
|
|
|
|
|
D |
E |
|
|
|
|||||||||
|
G |
|
|
Q |
|
M |
R |
|
||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。A与D形成分子的空间结构可能是(填序号) 。
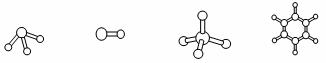
a b c d
图1
(4)从所给元素中组成合适的反应物,用化学方程式表明元素M、R的非金属性强弱:
。
(5)第三周期主族元素单质熔点高低的顺序如图2所示,“1”所代表物质的化学式是 ,“7”所对应的元素形成最高价氧化物的晶体类型是 。
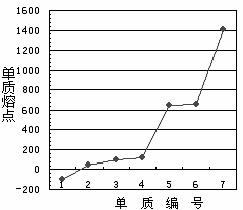
图2
16.(共4分)
某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是_________________。
15.X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y 2Z ,达到平衡后, X的转化率不可能为 ( )
2Z ,达到平衡后, X的转化率不可能为 ( )
A.25% B.20% C.15% D.10%
第Ⅱ卷(非选择题 共55分)
14.下列说法正确的是 ( )
A.将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝
B.向足量饱和石灰水中加入0.56 g CaO,可得固体0.74 g
C.由碱金属元素形成的单质熔点随原子序数的递增逐渐降低
D.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
13.下列表述正确的是 ( )
A.NaHCO3溶液中:c(H+) + c(H2CO3) = c(OH-)
B.中和等体积、等pH相同的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同
C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中:
c(H+) + c(M+) = c(OH-) + c(A-)
D.在水电离出的H+浓度为1×10-12 mol/L的溶液中,K+、Mg2+、NO3-、I-一定能大量共存
12.下列离子方程式书写正确的是 ( )
A.硫化钠水解:S2-+2H2O 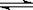 H2S↑+2OH-
H2S↑+2OH-
B.碳酸钠溶于醋酸溶液中:CO32- + 2 H+= H2O + CO2↑
C.次氯酸钙溶液中通入过量二氧化碳:Ca2+ + 2ClO-+H2O+CO2 =CaCO3↓+2HClO
D.过量的硫酸氢钠与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
11.有关下列表述 ( )
①16O2与18O2互为同位素
②C2H4与C6H12互为同系物
③淀粉与纤维素互为同分异构体
④白磷与红磷是同素异形体,它们之间的转化是物理变化
⑤碳与硅是同主族元素,故CO2与SiO2结构相似,性质相似
⑥PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
A.都不正确 B.只有①③⑤正确C.只有②④⑤正确 D.只有①②⑥正确
10.对于密闭容器中的可逆反应:mX(g)+nY(s) pZ(g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是 ( )
pZ(g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是 ( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com