
23.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
22.下列说法正确的是 ( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,他子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
21.(11分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg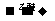 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
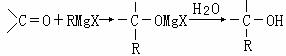
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有一定对称性。合成线路如下:
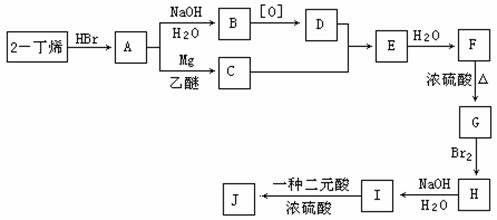
请按要求填空:
(1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ;
(2)C→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
《物质结构与性质》模块
22-24为选择题,每小题只有一个正确选项,每小题3分
20.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是 ( )
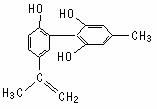
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol、7 mol
D.该分子中的所有碳原子不可能共平面
19.在C4H11N中,N原子以三个单键与其他原子相连接,它具有的同分异构体数目为( )
A.5 B.6 C.7 D.8
18.下列说法中正确的是 ( )
A.石油裂解可以得到氯乙烯
B.油脂水解可得到氨基酸和甘油
C.所有烷烃和蛋白质中都存在碳碳单键
D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖
17.(10分)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的化学式为_____________。
已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
(2)A与氢气加成生成2-甲基戊烷,则A的可能结构有___________种。
(3)B能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则B的结构简式为:
__________________,其命名为:
(4)C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:___________________________
以下是选考题,其中第18、19、20、21题为《有机化学基础》模块题,第22、23、24、25题为《物质结构与性质》模块题,第26、27、28、29题为《化学与技术》模块题。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。
《有机化学基础》模块
18-20为选择题,每小题只有一个正确选项,每小题3分
16.(10分) 工业纯碱中常含有少量NaCl杂质,可用下列装置测定纯碱中碳酸钠的质量分数。如图所示,从D处鼓入空气,A试管盛有NaOH溶液,E是盛有稀硫酸的分液漏斗,B广口瓶中放的是含有NaCl杂质的Na2CO3固体,C为盛有浓硫酸的试管,F、G均为盛有碱石灰的干燥管。
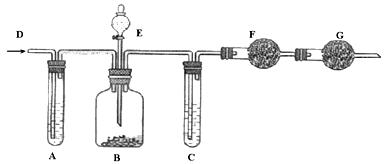
实验操作如下: ①检查装置的气密性;②在干燥管F内填满颗粒状碱石灰,其总质量为m1 g;③称取一定量的纯碱样品m2 g,并放入广口瓶中;④从分液漏斗中缓慢的滴入稀硫酸,至不再产生气体为止;⑤从D处缓慢鼓入空气数分钟,然后再称量干燥管F,其总质量为m3 g。回答下列问题:
(1)鼓入空气的目的是_____________________________________________。(1分)
(2)装置G的作用是_______________________________________________。(1分)
(3)装置A的作用是_______________________________________________。(1分)
(4)装置C的作用是_______________________________________________。(1分)
(5)样品中碳酸钠的质量分数计算式为_______________________________。(3分)
(6)如撤去装置A,则将导致实验结果___。(填“偏大”、“偏小”或“不变”) (1分)
(7)如撤去装置C,则将导致实验结果______。(1分)(填“偏大”、“偏小”或“不变”)
(8)上述实验操作中的④和⑤,都要求实验缓慢进行。如果这两步操作太快,则将导致实验结果__________________。(1分)(填“偏大”、“偏小”或“不变”)
15.(6分:每空2分)将1mol
I2(g)和2mol
H2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);
ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
2HI(g);
ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
(1)达平衡时,I2(g)的物质的量浓度为 mol·L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是 (填入下列条件的序号)。
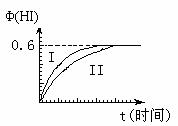
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和
c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为 (用一个含a、b、c的代数式表示)。
14.(10分:每空1分)如下图所示,A、B、C、D、E五种物质的相互转化关系
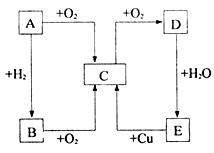
请回答:
(1)若A通常状态下为固态单质,A→E分别为(写化学式)A ;B ;
C ;D ;E 。
(2)若A通常状态下为气态单质,则A→E分别为(写化学式)A ;B ;C ;D ;E 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com