
1.(14分)某有机物X的相对分子质量小于100,1mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2112L。⑴该有机物X的分子式为 ▲ 。a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
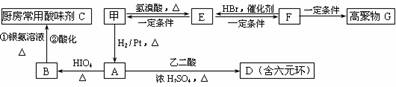
⑵甲物质是X的同分异构体,分子中含有羰基和羟基,物质甲能发生如下图所示的转化:
 已知:
已知: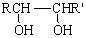
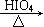 RCHO + R’CHO
RCHO + R’CHO
①B的名称是 ▲ 。
②A→D的反应类型为
▲ ,E→F的反应条件是
▲ 。③写出F→G的化学方程式:
▲ 。⑶物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1molH2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积比为2∶1∶1。PBS是一种新型生物降解塑料,其结构简式为 。请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)。提示:①可利用本题⑵中的信息。
。请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)。提示:①可利用本题⑵中的信息。
②合成路线流程图示例如下:
1.(1)N2(g)+3H2(g)
 2NH3(g) △H== -92kJ/molCD
2NH3(g) △H== -92kJ/molCD
(2)D 0.06mol/(L·min) D或d
(3)阴 N2+6H++6e===3NH3
2 (1)4 羟基 羧基 (2) ②⑤⑥
训练三
2.分子式为C12H1402的有机物F广泛用于香精的调香剂。
为了合成该有机物,某实验室的科技人员设计了下列合成路线
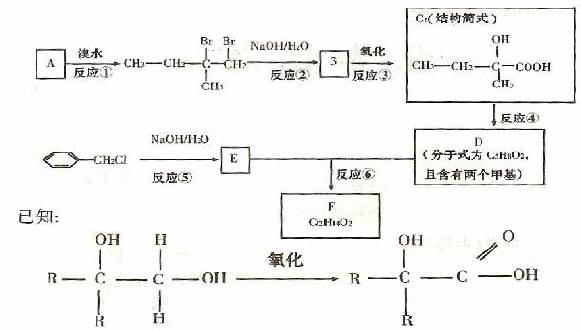
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;C物质的官能团名称
(2)上述合成路线中属于取代反应的是 (填编号);(3)反应④的化学方程式为
(4)G是E的同分异构体,且G属于芳香族化合物,能跟FeCl3溶液发生显色反应,苯环上的一氯代物有两种。G的结构简式为
19.(1)强 弱 (2)MOH==HA>HB 等于 (3)弱 等于
训练二
1(11分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
 ①写出氮气与氢气合成氨的热化学反应方程式: ②对于合成氨的反应下列说法正确的是
(填编号)
①写出氮气与氢气合成氨的热化学反应方程式: ②对于合成氨的反应下列说法正确的是
(填编号)
 A.该反应在任意条件下都可以自发进行
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
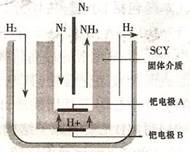
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。
请回答:铠电极是电解池的 极(填"阳"或"阴"),该极上的电极反应式是
16.
(1)8
(2)因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
 (3)如右图
(3)如右图
(4) H2O2 溶液由浅绿色变为血红色 3.3 洗涤 0.07a
19.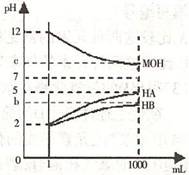 (7分)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH==2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(7分)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH==2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(1)HA为 酸,HB为 酸(填"强"或“弱")
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为 (用酸、碱化学式表示);
将稀释后的HA溶液利MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为 (填"大于"、"小于"或"等于")
(3)若b+c=14,则MQH为 碱(填"强"或"弱")。将稀释后的HB溶液和MOH溶液取等体积混合,所得很合溶液的pH 7(填"大于"、"小于"或"等于")
16.(12分)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是 mol.(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
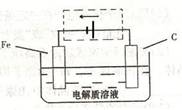
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:
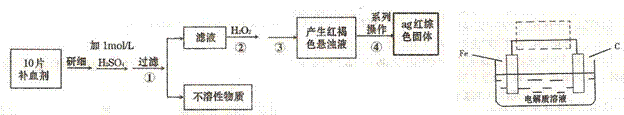
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH= (已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、 、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为 g.(用含a的式子表示)
10.(14分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生资源,具有广泛的开发和应用前景。请按要求回答下列问题:(1)工业上一般采用下列两种反应合成甲醇:
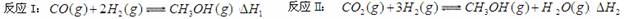
上述反应符合绿色化学“原子经济”的是__________________________________
下表所列数据是反应I在不同温度下的化学平衡常数(K)。
 某温度下,将2molCO和6molH
某温度下,将2molCO和6molH 充入2L的密闭容器中,充分反应,2分钟达到平衡后,测得c(CO)=0.2mol/L,则V(H
充入2L的密闭容器中,充分反应,2分钟达到平衡后,测得c(CO)=0.2mol/L,则V(H )=_____________,CO的转化率为__________,此时温度约为_______________℃。
)=_____________,CO的转化率为__________,此时温度约为_______________℃。
(2)已知在常温压下:
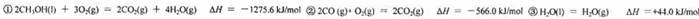
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
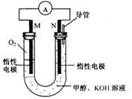 该电池正极的电极反应式为__________________________________________
该电池正极的电极反应式为__________________________________________
工作一段时间后,U形管中溶液PH逐渐(填:“变大”、“变小”或“不变”)
该电池反应还原剂的化学式为________________________________________
当其3.2g时,将有____________mol电子转移。
21.(本小题14分)设函数

(1)若 时函数
时函数 有三个互不相同的零点,求
有三个互不相同的零点,求 的范围;
的范围;
(2)若函数 在
在 内没有极值点,求
内没有极值点,求 的范围;
的范围;
(3)若对任意的 ,不等式
,不等式 在
在 上恒成立,求实数
上恒成立,求实数 的取值范围.
的取值范围.
20.(本小题13分)已知定点 及椭圆
及椭圆 ,过点
,过点 的动直线与该椭圆相交于
的动直线与该椭圆相交于 两点.
两点.
(1)若线段 中点的横坐标是
中点的横坐标是 ,求直线
,求直线 的方程;
的方程;
(2)在 轴上是否存在点
轴上是否存在点 ,使
,使 为常数?若存在,求出点
为常数?若存在,求出点 的坐标;如果不存在,请说明理由.
的坐标;如果不存在,请说明理由.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com