
19.[解析]本题以绿色氧化剂的合成、应用以及氧化还原滴定为背景设计而成的化学计算综合性试题。考试原子利用率、氧化还原守恒定律在化学计算中的应用能力,同时考查了学生对信息的获取、数据分析计算的能力。(2)与水的电离进行类比;(3)依据得失电子守恒,其中一份参加反应的氧气为:4.86g-3.9g=0.96g,设需H2O2溶液质量为m×17%/34 ×2 =0.96g/32 ×4 解得m=12.0g;依据反应:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,每5片中含H2O2的物质的量为:2.5×0.01000 mol·L-1×0.020L=5×10-4mol,每片中m(H2O2)= 5×10-4mol×34g/mol÷5=3.4×10-3g=3.4mg
[答案](10分)
(1)d (2分)
(2) H2O2 H+ + HO2- (或2H2O2
H+ + HO2- (或2H2O2 H3O2+ +HO2-)(2分)
H3O2+ +HO2-)(2分)
(3)12.0g (3分)
(4)3.4(3分)
18.[解析]该题以“奥索利酸的合成方法”为背景,从副产生的判断、反应类型、同分异构体数目的确定、手性碳原子数确定、有机副产物的推断、有机化合物结构简式的书写和简单有机化合物的合成路线等多角度考查学生对有机化学基础知识的掌握程度和应用能力。讲评有机合成时提醒学生注意:①本题涉及的同分异构体列举或数目时一定要按正确的程序,防止漏写或重复;②注意绿色合成中常用的试剂:碳酸二甲酯酰化试剂、CO与H2羰基试剂、H2O2等作氧化性试剂,离子液体作溶剂等。③关注一些经典合成,如香兰素的合成,用用β-紫罗兰酮合成ABA等。
④注意题中新给予的反应运用和基团的保护,如:
(1)烯
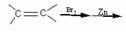
(2)醛、酮通过缩醛(或酮)来保护。
 ;
; 
(3)醇羟基变成醚(或酯)来保护。


(4)酚羟基变成苯甲醚来保护。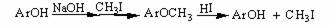
(5)芳香胺 做成酰胺保护氨基
实例:

本题的(4)原本准备设计冠醚的合成:(4)已知:①
②CH3CH2OH  CH3CH2Cl;③CH3CH2Cl+CH3CH2CH2OH
CH3CH2Cl;③CH3CH2Cl+CH3CH2CH2OH CH3CH2OCH2CH2CH3
CH3CH2OCH2CH2CH3
④
试以环氧乙烷为原料合成15-冠-5-醚(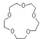 ,用合成路线流程图表示,并注明反应条件)。
,用合成路线流程图表示,并注明反应条件)。
提示:合成路线流程图示例如下:
因情景配合不好,不好放弃了。
[答案](12分)
(1)CO2(或Na2CO3)(2分),取代(2分)
(2)bcd(2分)
(3)11(2分) (两个醛基、两个羟基)
(4)(4分)
17.[解析]本题是以“教材中涉及的基础实验”为背景,考查学生对化学原理的应用水平,以及对实验问题的探究能力,传递复习或学习时应重视课本上的基础实验,学会提出问题、设计必要的实验解决问题,并正确运用实验事实解释问题,题目具有一定的开放性,本题重在判断、推理、验证。难度应该中等。
(1)取两去试管分别加入同浓度的稀硝酸和相同的铜片,在其中一支中加入少量硫酸铜晶体,比较两者开始产生气泡的时间。
(2)80min内温度只上升了2℃,说明温度变化不是主要原因。
(3)①吸收氮的氧化物,防止污染环境;②左侧通入NO2时,一部分NO2与水反应会生成硝酸,使硝酸浓度变大。
(4)NO2催化机理可能是在反应中得电子生成NO2-起催化作用(或答:NO2-对该反应也能起催化作用)。
16.[解析]本题以“肼的制备、肼的运用”设置的综合题,引导学生关注热点小分子的结构、性质、制备及用途。第(1)实际是肼的多种制备方法,其中2NH3+NaClO=H2NNH2+NaCl+H2O,学生较熟悉,本题是以尿素为原料在碱性介质中进行的反应,考查对化学方程式书写能力;(2)考查燃料电池知识,这是一个碱性电池,直接肼电池也有酸性电池,这时负极电极反应为:N2H4+4OH――4e-=N2+4H2O,正极:O2+2H2O=4OH-。
(3)考查盖斯定律和热化学方程式的书写;(4)考查反应条件的优化组合,选择转化率高、耗时短的条件。
[答案](8分,每空2分)
(1)CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+NaCl+2H2O
(写:CO(NH2)2 + NaClO = N2H4 + CO2 + NaCl ,不扣分)
近年来,给定信息条件下的化学方程式或是离子方程的书写有越考越烈之势。
(2)负极 (失去电子的在负极)
(3)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-947.6 kJ·mol-1 考查盖斯定律的应用,属于常规题型。
(4)④④③
15.[解析]本题是以“含硫废气和焦炉气”的综合利用为背景,从工艺流程、实验基础知识、反应原理、简单流量计算等角度考查学生对新知识、新情景的整合,试题关注学生对资源利用和环境保护理念的形成,运用化学知识解决实际问题的能力。
[答案](8分,每空2分)
(1)abcd (2)对苯二酚作还原剂,保证亚硫酸氢铵不被氧化(苯酚具有还原性的知识迁移)
(3)HSO3-+NH3·H2O = SO32-+NH4++H2O (或:HSO3-+NH3 = SO32-+NH4+)
(4)1.2∶1(或6∶5)。生成一种产品硫酸铵,由流程可知,SO2、、NH3的物质的量之比为1:2。
设含SO2烟气与焦炉气的流量比为x:y,则2%x : 4.8%y=1:2
14.[解析]工业流程图是江苏、上海及广东等高考卷必考题型,一般是常见简单物质实验合成,综合考查用化学的视角分析物质生产(制备)过程中出现的相关的化学问题。问题设计涉及工业技术、实验技术、元素及化合物知识和基本反应规律、反应条件的控制(温度、pH、投料比等)能量问题、绿色化工等。这类题学生难以把握答案。会识别流程图[箭头进入的是投料(反应物),箭头出去的是生成物(包括主物质和副产物)],会利用题给你新信息,正确运用的原理,解答这类试题一般程序:明确生产目的、看清理顺物料流向(出线、进线、回转的循环线)与相关反应、能量变化与物质变化、主产物与副产物,关注安全问题、环境问题、(物质、能量)循环利用问题等。另外课上涉及的流程或相似流程必须足够重视。
[答案](8分,每空2分)
(1)Mn2++2H2O-2e-=MnO2+4H+ (2)0.5 每生成1mol Na2CrO4转移电子3mol,KClO3中的氯从+5价降到-1价。所以得0.5mol KClO3
(3)2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)3ClO-+2Fe(OH)3 +4OH-= 2FeO42 -+3Cl-+5H2O
13.(10分)
[解析]本题是一道综合性物质制备试题,选取氯碱工业一次盐泥(与二次盐泥成分不同)原出于高校物质制备报告中实验材料编成,借此考查中学化学实验一些基本操作、实验原理及数据处理等,本题问题(3)不常见,注意判断其中的杂质离子是Fe3+若其它有色离子,某种原料不足问题,另外问题(5)灼烧至恒重称量问题,尽管旧教材突出,但这个知识点并没有消亡,最后问题设置时,近几年常与定量滴定把关。近年来江苏高考实验题:素材情景新颖、源头在高校教材落点在中学课本,问题设计着眼于多模块知识参与、突出探究性、结合图表、数据处理与结果应用全流程。按考试说明要求,能对探究方案、探究过程、探究结论等进行分析和评价,能准确地表述探究结果,并应用探究结果解决相关问题,实验简答题必须足够重视,注意答题时文字的切题、简约、规范、述语准确。
[答案](1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸(SiO2·nH2O) 沉淀,钙盐转化为硫酸钙沉淀而除去。(或浸出Mg、Fe、Al、Mn离子,除去Si、Ca)(1分)
(2)Al(OH)3、Fe(OH)3 (2分,写对一个得1分);
Mn2+ + 2OH-+ClO-= MnO2↓+Cl-+H2O(2分)
(3)添加适量的次氯酸钠溶液,再煮沸、过滤(1分)。
(4)减小硫酸镁的溶解损耗,并快速干燥(1分)
(5)称量→重复脱水→冷却→称量至恒重(1分)。
(6)38.4%(2分)(0.466g÷233 g·mol-1)×96 g·mol-1÷0.50g×100%=38.4%
12.AB
[解析]溶解度积的计算,在2010年的考试说明中有明确的要求。本题由图数据可计算出。Ag2CrO4的Ksp=1×10-11;在饱和溶液中加入CrO 离子,平衡移动,c(Ag+)减小,但两种离子的关系依然符合溶解度积的曲线。选项C:K=c(CrO
离子,平衡移动,c(Ag+)减小,但两种离子的关系依然符合溶解度积的曲线。选项C:K=c(CrO )/ c2(Cl-)= [Ksp(Ag2CrO4)/
c2(Ag+)]/[ Ksp(AgCl) 2/ c2(Ag+)],代入上述数据可得K=6.25×107 ;D选项,在c(Cl-)= 0.001mol/L时,c(Ag+)= Ksp(AgCl)/ c(Cl-)= 1×10-71mol/L,Qc(Ag2CrO4)=(1×10-7 )2 ×0.001=1×10-17 < Ksp(Ag2CrO4)所以Cl-先沉淀。
)/ c2(Cl-)= [Ksp(Ag2CrO4)/
c2(Ag+)]/[ Ksp(AgCl) 2/ c2(Ag+)],代入上述数据可得K=6.25×107 ;D选项,在c(Cl-)= 0.001mol/L时,c(Ag+)= Ksp(AgCl)/ c(Cl-)= 1×10-71mol/L,Qc(Ag2CrO4)=(1×10-7 )2 ×0.001=1×10-17 < Ksp(Ag2CrO4)所以Cl-先沉淀。
11. CD
[解析]本题考查了溶液溶液中盐的水解、弱电解质的电离、电荷守恒等化学变化的规律理解、整合与综合运用,主要的知识点涉及电荷守恒、物料守恒及二者的综合运用。
10.D
[解析]本题借助于臭氧的两种制法,考查了电极反应的书写,电解池内离子的流向,高压放电时氮气和氧气的微量反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com