
4.相对原子质量的有关计算的学习
在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子百分比一般是不变的。我们平常所说的某种元素的相对原子质量,是按各种天然同位素原子丰度算出来的平均值。下面,我们介绍各元素相对原子质量平均值的算法。
设问:对于具有同位素原子的元素来讲,应该怎样求其同位素的相对原子质量呢?
如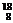 O的相对原子质量可以通过以下数值求出:已知一个
O的相对原子质量可以通过以下数值求出:已知一个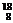 O的质量为2.657×10-26 kg,一个
O的质量为2.657×10-26 kg,一个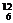 C的质量为1.993×10-26 kg,
C的质量为1.993×10-26 kg,
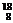 O的相对原子质量=
O的相对原子质量=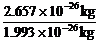 ×12=15.998
×12=15.998
只要我们知道了某元素的各种同位素的相对原子质量,及在自然界中各同位素原子丰度。根据元素相对原子质量的含义,就可得到其值。以氯元素为例,求氯元素的相对原子质量:
氯元素的相对原子质量=34.969×75.77%+36.966×24.23%=35.45
元素周期表中各元素的相对原子质量就是这样算出来的。在数值上,同位素的相对原子质量近似等于质量数,我们平常做题时,常用质量数代替同位素的相对原子质量来计算元素的近似相对原子质量。
3.同位素的学习
[投影]同位素的发现史,归纳同位素的概念和性质。
科学研究证明,同种元素原子的原子核中,中子数不一定相同。如组成氢元素的氢原子,就有以下三种:
[投影展示]
表1.2-2 三种不同的氢原子
|
原子符号 |
质了数 |
中子数 |
氢原子名称和简称 |
①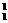 H H |
|
|
氕(H) |
②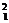 H H |
|
|
氘(D) |
③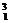 H H |
|
|
氚(T) |
也就是说,质子数相同中子数不同的原子间互称为同位素。如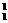 H、
H、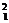 H和
H和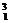 H三种核素均是氢的同位素。我们把它们分别叫做氕、氘、氚,为了便于区别,又把它们分别记做H、D、T。此处的“同位”是指这几种原子的质子数(核电荷数)相同,在元素周期表中占据同一个位置的意思。
H三种核素均是氢的同位素。我们把它们分别叫做氕、氘、氚,为了便于区别,又把它们分别记做H、D、T。此处的“同位”是指这几种原子的质子数(核电荷数)相同,在元素周期表中占据同一个位置的意思。
设问:截止到1999年,人们已经知道了115种元素,能不能说人们已经知道了115种原子?为什么?(不能。因为许多元素有多种同位素原子,即原子种类要比元素种类多)。
同位素不但在科学研究方面有重要的用途,在日常生活、工农业生产等方面也能大显身手。
[视频]同位素的应用
需要说明的是,同一元素的各种同位素虽然核内中子数不同(或说质量数不同),但它们的化学性质基本相同。
1.2×108 t,形象地可以比喻为需要3000辆载重4 t的卡车来运载。
[表1.2-1]
|
构成原子的粒子 |
电 子 |
质 子 |
中 子 |
|
电性和电量 |
1个电子带1个单位负电荷 |
1个质子带1个单位正电荷 |
不显电性 |
|
质量/kg |
9.109×10-31 |
1.673×10-27 |
1.675×10-27 |
|
相对质量 |
1/1836(电子与质子质量之比) |
1.007 |
1.008 |
通过上表我们知道,构成原子的粒子中,中子不带电,质子带正电,电子带负电。
我这儿有一把铁锁,(举起铁锁)接触它是否会有触电的感觉?(不会)。
金属均由原子构成,而原子中又含有带电粒子,那它为什么不显电性呢?
因为原子内部,质子所带正电和电子所带负电电量相等、电性相反,因此原子作为一个整体不显电性。
从原子的结构我们可知,原子核带正电,其所带的电荷数--核电荷数决定于核内质子数,我们用Z来表示核电荷数,便有如下关系:核电荷数(Z)=核内质子数=核外电子数。
从表中可看出,质子和中子的相对质量均近似等于1,而电子的质量只有质子质量的1/1836,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似值加起来,所得数值便近似等于该原子的相对原子质量,我们把其称为质量数,用符号A表示。中子数规定用符号N表示。则得出以下关系:质量数(A)=质子数(Z)+中子数(N)
在化学上,我们用符号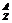 X来表示一个质量数为A,质子数为Z的具体的X原子。如
X来表示一个质量数为A,质子数为Z的具体的X原子。如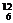 C表示质量数为12,原子核内有6个质子的碳原子或原子核内有6个质子和6个中子的碳原子。
C表示质量数为12,原子核内有6个质子的碳原子或原子核内有6个质子和6个中子的碳原子。
2.原子结构的学习
首先播放视频:原子的结构(没有条件的可以用文字的形式把这部分内容展示给学生)。
设问:请大家说出构成原子的粒子有哪些?它们怎样构成原子?
构成原子的粒子主要有质子、中子、电子;其中,质子和中子构成了原子的原子核,居于原子中心,电子在核外做高速运动
形象地比喻一下原子核和原子的体积的相对大小?
如果把原子比作一座十层大楼,原子核就像放置在这所大楼中央的一个樱桃。
如果假设原子是一座庞大的体育场,而原子核只相当于体育场中央的一只蚂蚁。
确切地讲,原子核的体积只占原子体积的几千万亿分之一。原子核虽小,但并不简单,它是由质子和中子两种粒子构成,几乎集中了原子的所有质量,且其密度很大。
[投影展示有关原子核密度的资料]
原子核密度很大,假如在1 cm3的容器里装满原子核,则它的质量就相当于
1.复习引入
复习提问:卢瑟福提出的原子结构的行星模型的具体内容什么?原子究竟具有怎样的结构?
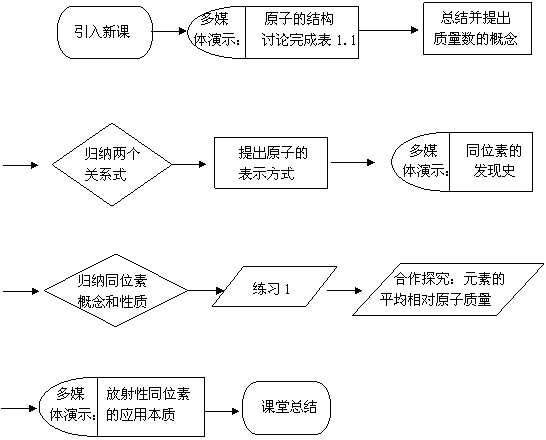
3.流程图说明
(1)引言:可以复习原子结构的行星模型,通过设问激起学生的探究欲望。
(2)视频:原子的构成。从中学生可看出质子、中子与电子,并讨论比较这三种粒子。构成原子的粒子中,中子不带电,质子带正电,电子带负电,并理解原子作为一个整体不显电性的原因。
(3)教师提示电子质量很小,原子的质量主要集中在原子核上,从而引出质量数的概念。
(4)学生根据质量数的概念和原子是电中性的,归纳出两个重要的关系式:
核电荷数(Z)=核内质子数=核外电子数,质量数(A)=质子数(Z)+中子数(N)
(5)用符号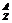 X来表示一个质量数为A,质子数为Z的具体的X原子。
X来表示一个质量数为A,质子数为Z的具体的X原子。
(6)视频:同位素的发现史。
(7)从中引导学生归纳出同位素的概念和性质。
(8)通过练习1,即课本P14第1题,让学生进行巩固与应用的训练。
(9)通过元素存在同位素,学生讨论得出元素的平均相对原子质量的计算方法。
(10)视频:放射性同位素的应用。拓展学生的视野,激发学生的学习热情。
(11)由学生总结本节课的内容,即时梳理知识点。
2.流程图
1.设计思想
本节课内容有两部分:一是原子结构;二是同位素。新教材先讲述原子结构,再明确质量数的概念,最后在原子核结构的基础上提出了同位素的概念。内容这样安排使学生思路清晰、流畅。
本节教学内容无演示实验,理论性较强,学生对此处的内容容易产生枯燥感。为此,采用了旧中引新、设问激疑的方法,对学生进行精心的引导,并结合形象的比喻,多媒体视频,让学生亲自参与到学习新知识的过程中来,最后通过对所学知识的应用--练习,使本节课的知识得以巩固。
在设计方案过程中尽量调动激活学生的思维。层层设问,学生不时产生认知冲突。
在强化训练书写时可以通过“自主、合作训练”增强趣味性,让学生体验自主、合作探究及训练后获得成功的喜悦。
多媒体
2.难点
同位素的概念,有关相对原子质量的计算。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com