
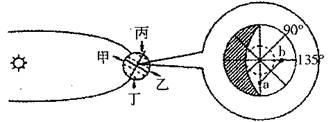
每天清晨,有许多人天安门广场观看国旗与太阳同时升起,如果天安门广场连续三天的升旗时间如下表所示,据此回答1-2题。
|
|
升旗时间 |
|
第一天 |
5:49 |
|
第二天 |
5:50 |
|
第三天 |
5:51 |
1.关于这段时间里地球运动产生现象的正确叙述是 ( )
A.太阳直射点位于北半球,产逐渐向南移动
B.地球的公转速度在减慢
C.南半球的昼长越来越短
D.烟台的正午太阳高度角逐渐增大
2.这段时间里,下列现象不可能出现的是 ( )
A.我国东南沿海多台风活动
B.华北地区农民开始准备播种小麦
C.新疆的果农喜摘葡萄,晾晒准备出口的葡萄干
D.长江中下游地区正值梅雨季节
24.阐读下列材料,并结合所学知识回答问题。
材料一 在对工业文明的一片批判声中,一批思想家也走上前台,发出了另一种声音,他们坚决为现有的工业制度和社会体制辩护呐喊,这批思想家主要有英国经济学家亚当·斯密、大卫·李嘉图 ……
在斯密看来,市场的自由竞争实现了社会生产要素和资源的有效配置,引导着人们实现着个人利益,也增进着国家的财富,这是现行社会经济运行的内在机制,是个人财富与国民财富增长的动力。就生产形式而言,自由竞争并不会带来生产的无序化。相反,在市场的自由调节下,社会在均衡的生产,实现自然的和谐与有序。斯密坚定地认为,每一个人,在他不违反正义的击律时,都应听其完全自由,让他采用自己的方法,追求自己的利益,以其劳动度资本和任何其他人或其他阶级相竞争了,只有这样,才能调动每个人的积极性,才能激活起“经济人”天生具有的一种创造欲望和创新能力。
--王斯德主编《世界通史》
材料二 凯恩斯在《就业、利息和货币通论》(1935-1936年)及其他著作中认为:投资对利率变动与未来收益的预期反应灵敏,是捷定经济活动水平的动态因素。这就表明政府采取谨慎而适当的行动是能够恢复经济、实现充分就业的。改变税收政策和公共支出,政府就能直接影响商品和劳务的需求量;通过金融倾向政策以控制利率,政府就间接影响投资的水平。
--摘自《简明不列颠百科全书.凯恩斯经济学》
材料三 新的形势已经向传统的经济学派如凯恩斯主义等提出了严峻的挑战.一批新的经济学理论和流派应运而生。现代货币学派、供给学派、新凯恩斯学派和现代制度主义是纷繁复杂的诸多经济流派中最具代表性和最具影响力的派别。 所谓供给学派,是和凯恩斯的合理需求理论相对立的,是强调经济结构中供给方面的重要性,并从中寻求对策的理论。
--摘自吴于廑、齐世荣主鳊《世界史-现代史编》
(1)根据材料一和所学知识,归纳亚当·斯密经济思想及基本主张。(5分)
(2)根据材料二和所学知识,凯恩斯的经济思想与亚当·斯密相比有什么不同?(2分)分析凯恩斯经济思想的实质及这种经济思想给资本主义国家带来的影响。(6分)
(3)20世纪70年代,凯恩斯主义为什么会受到严峻的挑战?(1分)根据材料三概括供给学派的经济思想与凯恩斯主义的不同之处。(1分)
20.(10分)某化学兴趣小组探讨Fe3+与SO32-之间的反应情况,请您参与并协助完成实验。
(1)提出猜想:①发生氧化还原反应。请你配平反应的离子方程式
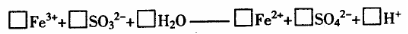
②发生双水解反应。其反应的离子方程式
2Fe3++3SO32-+6H2O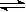 Fe(OH)3(胶体)+3H2SO3
Fe(OH)3(胶体)+3H2SO3
(2)实验验证:
①检验Na2SO3溶液是否变质。取Na2SO3溶液,加入过量盐酸后,再加入BaCl2溶液,无沉淀产生。结论:_________________________________写出有关反应的离子方程式:
②取5mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到:溶液由黄色变为红棕色。无气体产生,也没有沉淀产生。
③将②溶液加入过量稀盐酸,分成两等份,一份加入BaCl2溶液,产生白色沉淀;另一份加入几滴KSCN溶液,溶液呈血红色。
(3)得出结论:根据上述实验现象,得出Fe3+与SO32-之间发生反应的情况是:
(4)拓展探究:实验小组的一位同学在FeCl3溶液中加入Na2CO3溶液,观察到有红褐色沉淀产生,并有无色气体放出。
①写出反应的离子方程式:
②SO32-的水解能力___________CO32-(填“大于”,“小于”)
19.(12分)H2O2是重要的氧化剂,还原剂,它的水溶液常用来消毒、杀菌、漂白等。
请回答下列有关问题。
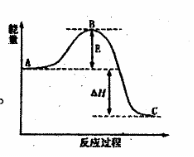 (1)2H2O2(l)=2H2O(l)+O2(g)反应过程中
(1)2H2O2(l)=2H2O(l)+O2(g)反应过程中
的能量变化如图所示。已知1 mol H2O2分解
为1 mol H2O的△H=-98.23 kJ·mol-1
①H2O2的分解反应常温下能自发进行,其原
因是 。
该反应常用MnO2作催化剂,则加入MnO2
会使图中B点 (填“升高”、
“降低”),图中△H= 。
(2)H2O2和H2O都是极弱电解质;水电离生成H3O+和OH-即:H2O+H2O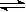 H3O++OH-叫做水自偶电离;H2O2也有极微弱的自偶电离,其自偶电离的方程式为
H3O++OH-叫做水自偶电离;H2O2也有极微弱的自偶电离,其自偶电离的方程式为
(3)某化学兴趣小组用酸化KMnO4标准溶液滴定H2O2溶液样品,测定H2O2溶液中H2O2的含量。其反应的离子方程式为:
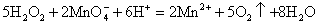
①酸化KMnO4溶液不能放在碱式滴定管中,原因是
②用KMnO4溶液滴定H2O2样品,终点时溶液颜色变化为
③滴定时,若滴定管中滴定液下降到活塞处才达到滴定终点,则能否由此得出准确的测定结果,原因是什么?
18. (13分)金属的单质及其化合物与工农业生成、日常生活有密切的联系。请回答下列问题:
(13分)金属的单质及其化合物与工农业生成、日常生活有密切的联系。请回答下列问题:
(1)一定温度下,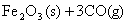
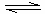
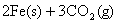
①请用上述反应中某种气体的有关物质理量来说明反应已达平衡状态(若有多种,只回答两种即可)
i
ii
②若平衡时,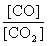 比值随温度的升高而增大,则该反应的正反应是
反应(填“吸热”或“放热”)
比值随温度的升高而增大,则该反应的正反应是
反应(填“吸热”或“放热”)
(2)钢铁发生电化腐蚀时,负极电极反应式为
(3)水体中铅污染问题备受关注,铅在水溶液中的各种存在形态浓度分数随溶液pH变化关系如图所示。
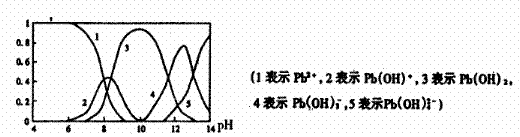
①往Pb(NO3)2溶液中滴入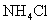 溶液后,
溶液后,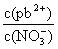 减小,可能的原因是
减小,可能的原因是
②向铅污染的水中加入脱铅剂(用EH表示),脱铅过程中主要发生如下反应:
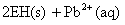
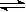
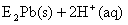
则:该反应的平衡常数数表达式为K= ;脱铅反应最合适的pH范围为6-7,请解释原因:
③向含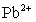 的污水中加入FeS固体,也可除去
的污水中加入FeS固体,也可除去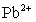 的污染,当
的污染,当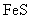 合
合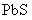 同时存在时,溶液中
同时存在时,溶液中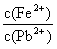 =
[已知:
=
[已知: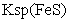 =6.8×10-18mol2·L-2;
=6.8×10-18mol2·L-2;
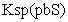 =3.4×10-28 mol2·L-2]
=3.4×10-28 mol2·L-2]
17.(14分)海洋是资源的宝库,蕴藏丰富的化学元素。氯元素就是其中之一。
(1)在光照情况下,H2和Cl2发生如下反应:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
则:氯元素在元素周期表中的位置是 ;
在短周期主族元素中与氯元素相邻元素原有半径从大到小顺序是
反应②中形成的化学键属于 (填“离子键”或“共价键”)
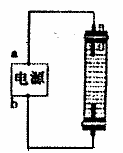 (2)某同学用石墨作电极,设计一种如右图所示的家用环保型消
(2)某同学用石墨作电极,设计一种如右图所示的家用环保型消
毒液发生器,为使Cl2完全吸收,则a为 极(填
“正”、“负”);与b极相连石墨电极上发生反应的电极反应
式 。
(3)常温下,将NaCl固体放入烧杯中,加入适量水充分溶解后,
烧杯中仍有少量NaCl固体;再向烧杯的溶液中通入HCl气
体,法线烧杯中固体增多。请分析原因:
(4)NH4Cl是一种重要的化肥。
①用0.1 mol·L-1的盐酸滴定0.1 mol·L-1的氨水,滴定过程中不可能出现的结果是:
a.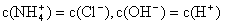
b.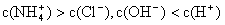
c.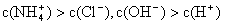
d.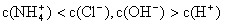
②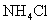 溶液中存在:
溶液中存在: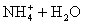
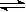
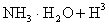 ,则该反应常温下的平衡常数K=
(已知:常温下,
,则该反应常温下的平衡常数K=
(已知:常温下,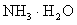 的电离平衡常数Kb=1.7×10-5 mol·L-1)
的电离平衡常数Kb=1.7×10-5 mol·L-1)
16.(6分)请回答下面两个问题
(1)对于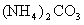 溶液,某同学写出了如下的正确关系式:
溶液,某同学写出了如下的正确关系式:
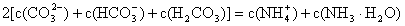
请分析该同学的依据是
(2)某反应:A(g)+B(g)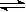 C(g)在任一时刻的正、逆反应速率可用
C(g)在任一时刻的正、逆反应速率可用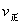 、
、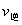 表示:
表示: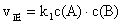 ,
,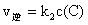 ,其中
,其中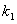 、
、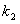 在一定温度下均为常数。c(A)、c(B)、c(C)分别表示某时刻三种物质的物质的量浓度(mol·L-1)。
在一定温度下均为常数。c(A)、c(B)、c(C)分别表示某时刻三种物质的物质的量浓度(mol·L-1)。
①上述反应达到平衡时,物质C与A、B的浓度关系可表示为 。
②在300 K时,开始反应时的A、B浓度均为0.1 mol·L-1,达到平衡时B的转化率为50%,则该温度下反应的平衡常数= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com