
14.[湖北省黄冈市2008年秋季高三年级期末考试化学](8分)Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7,等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL 0.100mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250rnL 容量瓶、玻璃棒外,还需要 。
(2)需准确称取Na2S4O3固体的质量为 g。
(3)另取废水50.00mL,控制适当的酸度加人足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O2溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度.
答案..(1)设Ba2+为x mol,则有
Ba2+~BaCrO2~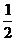 Cr2O72-~
Cr2O72-~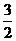 I2~3S2O32-
I2~3S2O32-
1mol 3mol
x mol 36.00×0.100×10-3mol
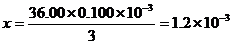 mol(1分)
mol(1分)
所以c(Ba2+)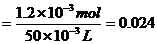 mol·L-1(1分)
mol·L-1(1分)
13.[河北正定中学2009届高三第四次月考]印染工业常用亚氯酸钠(NaClO2)漂白织物,亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-,其中HClO2是漂白剂的有效成分,ClO2是有毒气体。各组分含量随pH变化情况如图所示,由图知,使用该漂白剂的最佳pH为[ B ]
A.<3.0 B.4.0-4.5 C.6.5-7.0 D.>9.0
12. [河北正定中学2009届高三第四次月考]若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,则可能的原因是[ BD ]
A.生成了一种强酸弱碱盐 B.弱酸和强碱的反应
C.强酸和弱碱的反应 D.弱酸和弱碱的反应
11.[河北正定中学2009届高三第四次月考]常温下,将pH=9的Ba(OH)2溶液稀释500倍,稀释后c(Ba2+ )和c(H+)之比约为[ C]
A.1:1 B.1:2 C.1:10 D.10:1
9.[名校联盟 2008--2009学年高三第一学期期末考试]将足量等质量的镁铝合金分别加入到下列四种溶液中,充分反应后,放出氢气最多的是[B]
A.15 mL pH=13氢氧化钠溶液 B.50 mL pH=1的醋酸溶液
C.50 mL pH=1的硫酸溶液 D.80 mL 5 mol·L-1硝酸溶液
10[名校联盟 2008--2009学年高三第一学期期末考试](17分)Ⅰ.化学是一门以实验为基础的自然学科,化学实验在化学学习中具有极其重要的作用。下列关于实验的叙述正确的是 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.在两支试管里分别加热NH4Cl和NH4HCO3,现象完全相同
C.在铝热反应的实验中,直接用酒精灯将铝热剂点燃
D.区别NO2气体和溴蒸气时,可将气体分别通入硝酸酸化的AgNO3溶液中
E.用滴有酚酞的水做氨的喷泉实验,只验证了氨的溶解性
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
⑴将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
⑵取10.00mL待测液,用 式滴定管量取。
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定到终点。
⑷根据下列数据,烧碱的纯度为 。
|
滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
⑸以标准的盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
答案.Ⅰ AD (2分,只选一个且正确给一分,有错选得0分)
Ⅱ⑴250mL容量瓶(2分,写“溶”不给分,规格不答扣一分)、胶头滴管(2分,无“胶头”扣一分)
⑵碱(2分,答“碱式”不扣分)
⑶锥形瓶中溶液颜色的变化(2分,未答“颜色”扣一分)
⑷93.5% (2分,未用百分数表示不扣分)
⑸①偏小 ②偏大 ③偏大 ④偏大 ⑤无影响 (各1分)
7.[广西南宁武鸣高中09届高中化学2月调研试卷](11分)某温度(t℃)时,水的Kw=1×10-12,则该温度(填“>”、“<”或“=”)
25℃,其理由是
。
⑴将此温度下pH=11的NaOH与pH=1 HCl等体积混合,混合后溶液pH= ;
⑵将此温度下pH=9的Ba(OH)2溶液取出1mL,加水稀释至10000mL,则稀释后溶液
c(Ba2+)﹕c(OH-)= ;
⑶将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合:
①若所得混合液为中性,则a﹕b= ;
②若所得混合液的pH=2,则a﹕b= 。
答案.> (1分); 水的电离过程是吸热过程, 升高温度, 能促进水的电离, 水的离子积常数增大, 温度大于25℃(2分)
(1)PH=6(2分) (2)1:20(2分)
(3)①1:1 (2分) ②9:11(2分)
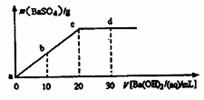 8.[2009年阳泉市十五中学高三第二次理综考试化学部分]常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是 ( A
)
8.[2009年阳泉市十五中学高三第二次理综考试化学部分]常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是 ( A
)
A.a~d溶液的pH:a<b<c<d
B.a~d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c(OH-)相等
D.c处溶液和d处溶液均呈碱性
6、[09海南中学高三化第四次月考.22)](10分)某温度时,水的离子积为Kw=1× 10-13,则该温度(选填大于、小于或等于) 250C,其理由是 。
若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(设混合后溶液的体积变化不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合溶液为中性,则a:b= ;
(2)若所得混合溶液的PH=2,则a:b= ;
答案.大于 水的电离是吸热的加热促进水的电离KW增大
(1)10:1 (2)9:2
5、[09海南中学高三化第四次月考.16)]6分)常温下、在10ml pH=4的盐酸中加水,稀释到100ml时,溶液的pH为 ;若加水稀释到1000ml时,溶液的pH为 ;若加水稀释到1000L时,溶液的pH
为
 16、5 6 7
16、5 6 7
4、[09海南中学高三化第四次月考.12)]室温下,下列混合溶液的PH一定小于7的是(C )
A PH=3的盐酸和PH=11的氨水等体积混合
B PH=3的盐酸和PH=11的氢氧化钡等体积混合
C PH=3的醋酸和PH=11的氢氧化钡等体积混合
D PH=3的硫酸和PH=11的氨水等体积混合
3.[河北冀州中学08-2009学年度高 三上学期期末考试]下列说法不正确的是( A )
A.100℃时,纯水中c(H+)=1×10-6mol·L-1,pH小于7,此时纯水显酸性
B.pH=12的烧碱和氢氧化钡溶液,二者物质的量浓度之比为2∶1
C.pH=3的盐酸与pH=5的硫酸等体积混合,pH=3.3
D.0.1mol·L-1CH3COOH溶液中;c(CH3COOH)>c(CH3COO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com