
题目列表(包括答案和解析)
8、在密闭容器中进行反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系: υ(B)=3υ(A);3υ(C)=2υ(B)。则此反应可表示为( )
A A+B=2C B A+3B=2C
C 3A+B=2C D A+B=C
7、下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
|
编号 金属(粉末状) 酸的浓度及体积
反应温度 (mol) (℃) |
|
A
Mg,0.1
6 mol·L-1 硝酸10mL
80 B Mg,0.1 3 mol·L-1 盐酸10mL 60 C Fe,0.1 3 mol·L-1L 盐酸10mL 60 D Mg,0.1 3 mol·L-1 硫酸10mL 60 |
6、下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
5、 S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法正确的是( )
A.△H3=-0.33 kJ·mol-1 B.单斜硫的能量比正交硫的能量低
C.S(单斜,s)=== S(正交,s) △H3>0,正交硫比单斜硫稳定
D.S(单斜,s)=== S(正交,s) △H3<0,单斜硫比正交硫稳定
4、已知 (1)H2(g)+1/2O2(g)===H2O(g); △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g); △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l); △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l); △H4=d kJ·mol-1
下列关系式中正确的是( )
A、a<c<0 B、b>d>0 C、2a=b<0 D、2c=d>0
3、下列说法正确的是( )
A、1 mol 硫酸与1mol Ba(OH)2 完全中和所放出的热量为中和热
B、在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D、101 kPa时,1 mol 碳燃烧所放出的热量为碳的燃烧热
2、下列说法不正确的是( )
A、放热反应不需加热即可发生
B、化学反应过程中的能量变化除了热能外,也可以是光能、电能等
C、需要加热才能进行的化学反应不一定是吸热反应
D、化学反应热效应数值与参加反应的物质多少有关
1、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
14、(14分)将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:
3A(气) + B(气)  xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 试计算:
xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 试计算:
(1)x = A 的平均反应速率 (2) 平衡时C的浓度
(3) 平衡时B的转化率
(4) 平衡时,容器内的压强与原容器内压强的比值
高二 化学科答题纸
选择题
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
非选择题
|
11(11分) (1) (2)① ② 12.(15分) (1) (2) 13.(18分) (1)K= K值 (2) (3) (4) (5) 14(14分) (1)x= (2) (3) (4) |
13、(18分)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):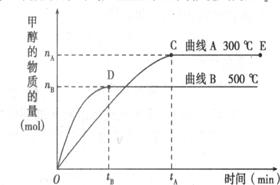 根据题意完成下列各题:
根据题意完成下列各题:
⑴反应达到平衡时,平衡常数表达式K=
升高温度,K值 (填“增大”“减小”或“不变”)。
⑵5000C ,从反应开始到平衡,氢气的平均反应速率v(H2)= (用nB、 tB 表示)
⑶在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
⑷可逆反应:CO(g)+
2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2 的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
⑸据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com