
题目列表(包括答案和解析)
4.把1120 mL(标准状况时的体积)氯化氢溶解于水,配制成500 mL溶液,该溶液的氢离子浓度为 mol / L,溶液的pH为 。(MCE87.一.5)
3.在200 mL氢氧化钡溶液中含有1×10-3 mol的钡离子,溶液的pH为____。将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是______。
2.试论述:“pH等于3的酸溶液与pH等于11的碱溶液以等体积混和后, 溶液的pH可能等于7,也可能大于7或小于7。”这一结论正确的理由。
①___________________________________________________;
②___________________________________________________;
③___________________________________________________。
1.判断下列四种溶液的酸碱性强弱:
A. 0.5 mol / L的NaOH溶液和1.0 mol / L的盐酸等体积混合后的溶液
B. pH=0的溶液
C. c(OH-)=10-11 mol / L的溶液
D. 0.1mol / L的CH3COOH溶液(α=1.32%)
它们酸性由强到弱的顺序(填写代码)是:______ > ______ > ______ > ______。
23.(12分)聚合氯化铝晶体[A12(OH)nCl6-n。·H2O]m是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:
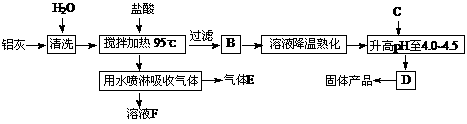
(1)反应中副产品E是 (用化学式表示);
(2)升高pH至4.0-4.5的目的是 ;
(3)生产过程中可循环使用的物质是 (用化学式表示) ;
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用 (填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)为测定[A12(OH)nCl6-n。·H2O]m中的n值,进行如下实验:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg固体。
②另取a g晶体,进行如下操作:
用A试剂溶解加足量AgNO3溶液操作c烘干称量为c g固体。
操作C为 、 (填操作名称)。
n= (用含a、b、c的代数式表示)。
高州一中2009-2010第二学期高二学科竞赛
22.(12分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。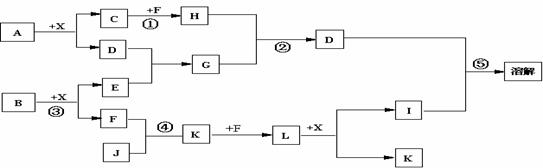
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:反应② ;
⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
21.(14分)现有含烃基R-的有机物R-OH,该物质遇FeCl3溶液显紫色,其蒸气的密度是相同状况下氢气的47倍。工业上ROH可由如下途径获得:
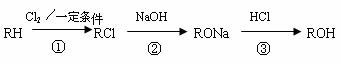
请回答:
(1)反应①的化学方程式为 _____________ _____________________,反应类型_________。
(2)反应②中,每生成 1 mol RONa, 需要消耗NaOH ______ mol 。
(3) 有机物W (C7H8O) 与ROH互为同系物, 任写一种W可能的结构简式_______ 。
(4)已知醇Z 与W互为同分异构体,且Z有如下的转化关系。

经测定,B分子中只含有如下结构片段各1个:
|
RCH2- |
-CH3 |
 |
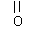 -O-C- -O-C- |
① B 的分子式为 __________ ;
② Z和D 生成A的方程式为:
___________________________________ ;
③ 有机物甲与D“结构相似,分子组成比D多2个CH2原子团”,且分子中除了饱和
烃基与D不同外,其余部分都与D相同。写出甲可能的结构简式:
_______________ 。
20.(10分)化学兴趣组的小张同学在一次实验中,偶然将黑色的四氧化三铁粉末投入到硫酸氢钠溶液中,居然发现硫酸氢钠溶液能溶解四氧化三铁!小张想知道硫酸氢钠溶液中的哪种粒子能使四氧化三铁溶解。请你和他一起通过实验完成这次探究活动。
 (1)小张同学提出的假设是: H2O、H+、Na+、SO42-中的某一种粒子能够使Fe3O4溶解
;
(1)小张同学提出的假设是: H2O、H+、Na+、SO42-中的某一种粒子能够使Fe3O4溶解
;
(2)实验探究过程:如图所示,取若干支装有0.2g四氧化三铁粉末的试管,向其中分别加入某些试剂,观察溶解情况(必要时可加热)。
(3)将有关试剂、现象填入下表(视情况而定,不必填满,不够可另加)。
|
实验 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
加入试剂 |
|
|
|
|
|
|
|
粉末是否溶解 |
|
|
|
|
|
|
(4)探究结果为: 。
19.(10分)在100℃,将2.00mol的N2O4气体充人4L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
|
时 间/s |
0 |
20 |
40 |
60 |
80 |
|
n(N2O4)/ mol |
2.00 |
c1 |
1.00 |
c3 |
a |
|
n(NO2)/ mol |
0 |
1.20 |
c2 |
2.4 |
2.4 |
(1)在0s-20s内N2O4的平均反应速率为 。
(2)表中c2 c3 a(选填“>”、“<’’或“=”),该反应的平衡常数为 。
(3)若在相同情况下最初向该容器充人的是NO2气体,要达到上述同样的平衡状态, NO2的起始物质的量是 mol。
18.(8分)实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气体产物有H2、N2、NO、NO2,溶液中产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围见下表。
|
生成产物 |
H2 |
N2和NH4+ |
NO |
NO2 |
|
c(HNO3)mol/L |
c<6.6 |
c<10 |
0.1<c<10 |
c>0.1 |
各气体产物成分及含量随HNO3浓度变化曲线如图所示。
(1)若硝酸与镁反应只生成N2气体,则反应的化学方程式为:
____________________________________________________。
(2)1.2g Mg与足量 4mol/L的HNO3完全反应,收集到280 mL(S.T.P)混合气体,其体积分别为H2_______mL、N2_______mL、NO______mL、NO2_______mL。除了上述混合气体外,是否还有其它还原产物? 答: 。(每空1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com