
题目列表(包括答案和解析)
3、下列各组元素属于p区的是 ( ) A、原子序数为1,2,7的元素 B、 Fe,Ar,Cl C、O, S,P D、Na,Li,Mg
2、据《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是( )
A、由二氧化碳合成金刚石是化学变化
B、金刚石是碳的一种同位素
C、钠被氧化最终生成碳酸钠
D.金刚石中只含有非极性共价键
1、法国里昂的科学家最近发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( ) A、该粒子不显电性 B、在周期表中与氢元素占同一位置
C、该粒子质量数为4 D、该粒子质量比氢原子大
18、(18分)全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
 ⑴
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
⑴
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
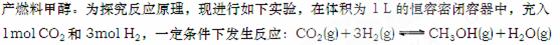 ⑵ 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生△H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
⑵ 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生△H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①  从反应开始到平衡,氢气的平均反应速率
从反应开始到平衡,氢气的平均反应速率
v(H2)=___________mol/(L·min);
② 氢气的转化率= ;
③ 该反应的平衡常数为 (保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤ 当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
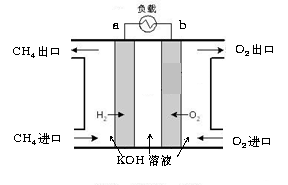 ⑶ 减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液从而达到吸收CO2的目的。请回答:
⑶ 减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液从而达到吸收CO2的目的。请回答:
① 通入甲烷一极的电极反应式为 ;
② 随着电池不断放电,电解质溶液的pH (填“增大”、“减小”或“不变”)。
③ 通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
2009-2010学年度第一学期高二年级期末模块检测
化 学 试 题 答 卷 纸
|
|

17、(10分)某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
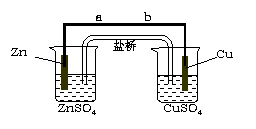
按照实验步骤依次回答下列问题:
⑴ 导线中电子流向为 (用a、b 表示)。
⑵ 写出装置中锌电极上的电极反应式: ;
⑶ 若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(不许用“NA”表示)
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
 C. 盐桥中的K+、Cl-都向右侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
⑸ 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
16、(14分)醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);
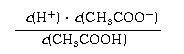
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
 ⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
;
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
;
C .醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹
常温时,有以下3种溶液,其中pH最小的是

⑺ 已知醋酸能 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
14、在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
|
序号 |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶解于酸的时间/s |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
30 |
t1 |
|
E |
2 |
薄片 |
35 |
50 |
|
F |
2 |
颗粒 |
15 |
t2 |
|
G |
2 |
粉末 |
15 |
t3 |
则下列说法正确的是:
① t1=75s ② t2>200>t3 ③ 单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C. 只有② D. 全部正确
第Ⅱ卷(共计58分)
 ① 从实验装置上看,图中尚缺少的一种玻璃仪器是
;
① 从实验装置上看,图中尚缺少的一种玻璃仪器是
;
② 大小烧杯之间填满纸屑的作用是 ;
③ 向组装好的量热器中加入50mL盐酸并测定温度,取出温度计并冲
净后,再将已测定好温度的NaOH溶液50mL加入量热器。下列加入50mL NaOH溶液的操作正确的是 。
A. 为了使酸碱充分中和,必须边滴加NaOH溶液边迅速搅拌
B. 把50mL NaOH溶液一次迅速倒入,盖上纸板迅速搅拌。
④ 若用醋酸代替上述盐酸实验,实验测得的中和热值 (填偏 大、偏小或无影响)。
大、偏小或无影响)。
⑵、用实验室准确配制的0.100mol/L的N aOH溶液测定某未知浓度的稀盐酸。
aOH溶液测定某未知浓度的稀盐酸。
 其具体实验步骤如下:
其具体实验步骤如下:
(填写颜色变化)且半分钟内不褪色时,即达到滴定终 点;
点;
④ 记录液面刻度读数。根据滴定管的两次读数得出消耗标准盐酸的体积,再 重复测定两次,实验结果记录见下表:
重复测定两次,实验结果记录见下表:
|
实验次数 |
起始滴定管读数 |
终点滴定管读数 |
|
1 |
0.00mL |
24.02mL |
|
2 |
0.50mL |
24.46mL |
|
3 |
1.00mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为 (保留小数点后3位)。
⑤ 如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果-稀盐酸浓度的影响是 (填“偏高”、“偏低”或“无影响”)。
0.1mol/L的NaCl溶液至不再有白色
沉淀生成,再向其中滴加0.1mol/L
的Na2S溶液,白色沉淀转化为黑色沉淀。
其沉淀转化的反应方程式为:
2AgCl(s)+S2-(aq)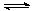 Ag2S(s)+2Cl-(aq) 。
Ag2S(s)+2Cl-(aq) 。
13、 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)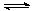 Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是:
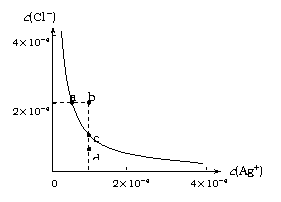 A. 加入NaCl可以使溶液由a点变到b点
A. 加入NaCl可以使溶液由a点变到b点
B. b点和d点均无AgCl沉淀生成
C. a点对应的Ksp大于c点对应的Ksp
D. 向0.1mol/L的硝酸银溶液中滴加
11、某温度下,对于反应N2(g)+3H2(g)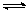 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。

 N2的平衡转化率(α-%)与体系总压强(P)的关系
N2的平衡转化率(α-%)与体系总压强(P)的关系
如右图所示。下列说法正确的是:
A. 将1.0mol氮气、3.0mol氢气,置 于1L密闭容器中
于1L密闭容器中
发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) < K(B) 。
C. 上述反应在达到平衡后,增大压强,H2的转化率提高。
D. 升高温度,平衡向逆反应方向移动,说明逆反应 速率增大,正反应速率减小。
速率增大,正反应速率减小。
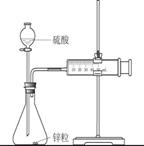
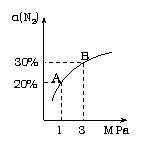
 时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL), 在该温度下,下列说法不正确的是:
时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL), 在该温度下,下列说法不正确的是:
A. 用锌粒来表示10s内该反应的速率为0.013g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L·s)
D. 用H2来表示10s内该反应的速率为0.004mol/(L·s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com