
题目列表(包括答案和解析)
4.药物是人类抵御疾病的重要武器之一。下列有关药物的说法不正确的是 ( )
A.“胃得乐”(主要成分为碳酸镁)是一种抗酸药



B.鸦片、吗啡、海洛因等这些物质属于毒品
C.青霉素能抑制细菌细胞壁的生长,致使细菌因细胞破裂而死亡
D.“阿司匹林”是一种重要的抗生素
3.纤维素被称为“第七营养素”,食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出的有害物质。从其化学成分看,它是一种 ( )
A.二糖 B.多糖 C.氨基酸 D.脂肪
2.下列不属于脂溶性维生素的是 ( )
A.维生素E B.维生素D C.维生素C D.维生素A
1.下面是4位同学对“化学与健康”这一话题发表的见解中,正确的是 ( )








A B C D
22.(8分)(1) a=16。
(2)n (NH3) =8 mol(3)5∶4 (4) 3∶3∶2
21.(16分)(1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变(2分)
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小(2分)
(2)40%(或0.4);0.06mol/L;(各2分)
(3)﹥;升高温度向正方向移动,故该反应是吸热反应 (各2分)
(4)0.014mol(L·min)-1;0.008mol(L·min)-1(各2分)
22.(8分)恒温下,将a
mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a=
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为 。
(3)原混合气体与平衡混合气体的总物质的量之比为 。
(4)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)等于 。

21.(16分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为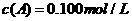 、
、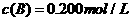 及
及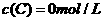 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
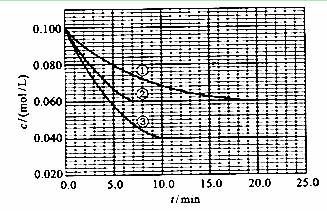
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②__________ _____;
③_________ _ ;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的 _________0,判断其理由是_________________
_;
_________0,判断其理由是_________________
_;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: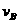 =__________________________________;
=__________________________________;
实验③: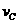 =__________________________________。
=__________________________________。
20. (14分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
(14分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
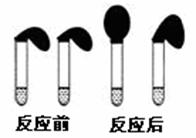
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大

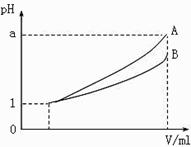 (3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000
mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
(3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000
mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
19. (8分)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
|
 净后没有干燥
净后没有干燥
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
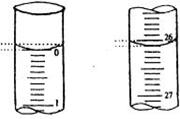
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:
则起始读数为______ mL,终点读数_______ mL;
(3)某学生根据三次实验分别记录有关数据如下:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:
c(NaOH)= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com