
题目列表(包括答案和解析)
10.下列实验基本操作错误的是
A 滴定管经蒸馏水洗净后,即可注入标准液进行滴定
B 玻璃导管蘸水后,边旋转边向橡皮管中插入
C 滴定用锥形瓶经蒸馏水洗净后,不须用标准液润洗
D 用玻璃棒蘸取待测液滴到pH试纸上,然后跟标准比色卡相对照,读出pH
9、将pH为5的盐酸溶液稀释500倍,稀释后溶液中c(Cl-)和c(H+)之比约为 ( )
A、1:2 B、1:5 C、1:10 D、10:1
8、25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度和水电离出的OH-离子浓度之比为
A.1010:1 B.5×109:1 C.108:1 D.1:1
7.某学生的实验报告所列出的下列数据中合理的是( )
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25 mL滴定管做中和滴定时,用去某浓度的碱溶液21.70 mL
6. pH、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下放出CO2气体的体积( )
A.醋酸多 B.硫酸多 C.一样多 D.无法比较
5、给蒸馏水中滴入少量氢氧化钠后,下列说法中错误的是 ( )
A、[H+ ][OH- ]乘积不变 B、pH增大了
C、[H+ ]降低了 D、水电离出的[H+ ]增加了
4、水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子发生电离,则n的值是 ( )A.1×10-14 B.55.6×107 C.107 D.55.6
2、下列仪器使用前不需检验是否漏水的有( )。 A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶www.k@s@5@ 高#考#资#源#网 3.把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5mol/L盐酸 C.0.5mol/L 醋酸溶液 D.0.5mol/LKCl溶液
1. 下列说法正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 氨气是弱电解质,铜是强电解质
C. 氧化钠是强电解质,醋酸是弱电解质
D. 硫酸钠是强电解质,硫酸钡是弱电解质
21、(10分)一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K= ;
根据右图,升高温度,K值将 (填“增
大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的
浓度变化表示的化学反应速率是 (用nB、
tB表示)
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a. 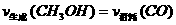 b.混合气体的密度不再改变
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a.C(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH物质的量增加 d.重新平衡C(H2)/C(CH3OH)减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com