
题目列表(包括答案和解析)
30、下图是一套制取并验证氯气部分化学性质的实验装置。
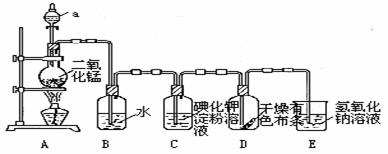
回答下列问题:反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+
Cl2↑
MnCl2+2H2O+
Cl2↑
(1)装置A中,仪器a的名称叫____________[“分液漏斗”或“长颈漏斗”选择],
该仪器中盛有的试剂为__ __。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”), 写出Cl2与水反应的方程式
[提示:氯气和水反应生成盐酸和HClO]
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为蓝色,这是因为氯气和碘化钾溶液反应产生________单质,能与____________溶液作用变蓝。
(4)装置E的作用是_____ ___。
(5) 请把MnO2+4HCl(浓) MnCl2+2H2O+
Cl2↑改写成离子方程式:
MnCl2+2H2O+
Cl2↑改写成离子方程式:
___________________________________________________________________
29、用化学用语完成下列填空
(1)H2SO4 电离方程式:__________________________________________________
(2)CH3COOH电离方程式: ______________________________________________
(3) 氨水和硫酸铝反应制氢氧化铝和硫酸铵的离子方程式:
_________________________________________________________________
23、 蛋白质是构成生命的基础物质。在鸡蛋、蔬菜、花生油等食物中,富含蛋白质的是 。"84消毒液”在日常生活中被广泛使用。该消毒液无色,对某些有色物质具有漂白作用,它的有效成分是 (填" KMnO4”或",NaClO")。
24下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。
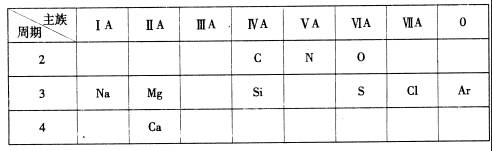 (1)金属性最强的元素是 (填元素名称);
(2)Ar原子结构示意图为 ;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C和N中,原子半径较小的是
;
(5)“高钙牛奶”中的钙是指
(填“元素”或“单质”);
(6)Si是带来人类文明的重要元素之一,其氧化物常用于制造 (填一种高性能的现代通讯材料的名称);
(7)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ________________________________________________
;
(8)O(氧元素)元素形成的一种氢化物的化学式是
,该物质中H元素与0元
(1)金属性最强的元素是 (填元素名称);
(2)Ar原子结构示意图为 ;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C和N中,原子半径较小的是
;
(5)“高钙牛奶”中的钙是指
(填“元素”或“单质”);
(6)Si是带来人类文明的重要元素之一,其氧化物常用于制造 (填一种高性能的现代通讯材料的名称);
(7)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ________________________________________________
;
(8)O(氧元素)元素形成的一种氢化物的化学式是
,该物质中H元素与0元
素的质量比 。(相对原子质量:H-1 0-16) 25(6分)
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,请用化学方程式表示该反应的原理: 。
(2)碳酸氢钠NaHCO3加热分解,请用化学方程式表示该反应的原理:
。
26从A.甲醛 B.葡萄糖 C.乙醇 D.乙酸 E.油脂 等五种有机物中选择合适的答案,将其标号填在空格内。
(1)工业上制备肥皂的主要原料是 。
(2)能用于除去热水瓶胆水垢(主要成分:CaCO3 ,Mg(OH)2)的是 。
(3)家居装修材料中散发出的有毒物质是
(4)常用做燃料和医药上消毒剂的是
(5)糖尿病人通常是指病人的尿液中 的含量高。
27 用C、Fe和Al组成的混合物进行如下图所示实验。

填写下列空白。
(1)气体X为 ,固体Z为 。
(2)写出铁和稀硫酸反应的方程式__________ _________ 。
(3)Y滤液中除有剩余的H+、Fe2+还有____________阳离子。
28

18、 实验室中配制250mL 0.20mo1·L-1NaOH溶液时,必须使用到的玻璃仪器是

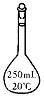 锥形瓶 试管 分液漏斗 容量瓶
A B C D
19、 不属于氧化还原反应的是
A、2Al+Fe2O3
锥形瓶 试管 分液漏斗 容量瓶
A B C D
19、 不属于氧化还原反应的是
A、2Al+Fe2O3 2Fe+Al2O3
B、2Mg+CO2
2Fe+Al2O3
B、2Mg+CO2 2MgO+C
C、N2+3H2
2MgO+C
C、N2+3H2 2NH3
D、SiO2+CaO
2NH3
D、SiO2+CaO CaSiO3
20、 在溶液中能大量共存的离子组是
A、H+、OH-、Na+ B、K+、NO3-、Cu2+
C、Ba2+、SO42-、Na+
D、Fe3+、OH-、NH4+
21、下列表达不科学的是
A.同周期元素,从左到右,原子半径逐渐减小,称有气体除外
CaSiO3
20、 在溶液中能大量共存的离子组是
A、H+、OH-、Na+ B、K+、NO3-、Cu2+
C、Ba2+、SO42-、Na+
D、Fe3+、OH-、NH4+
21、下列表达不科学的是
A.同周期元素,从左到右,原子半径逐渐减小,称有气体除外
B.酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 C.碱性强弱:NaOH <Mg(OH)2<Al(OH)3
D.同族元素,从上到下,原子半么逐渐增大 22、 下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是
|
试管 |
温度 |
过氧化氢溶液浓度 |
催化剂 |
|
A |
常温 |
3% |
-- |
|
B |
水浴加热 |
3% |
-- |
|
C |
水浴加热 |
6% |
MnO2 |
|
D |
常温 |
6% |
-- |
[选择题答案填写处]
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
|
|
|
|
|
|
|
|
|
|
|
|
1、 党的十七大报告提出,促进国民经济又好又快发展,要加强能源资源节约和生态环境保护。以下做法与此精神相违背的是
A.控制高能耗企业上马
B.加大对污染企业的整治力度
C.无节制地开采煤、石油、天然气等矿物资源
D.倡导“绿色化学”理念,逐步实现化工企业零排放
2、 NA为阿伏加德罗常数,下列物质所含分子数最多的是
A.0.8 mol二氧化碳
B.标准状况下2.24L氨气
C.3.6g水(水的摩尔质量为18g·mol-1)
D.含NA个氢分子的氢气
3、 垃圾的再生利用是垃圾资源化的最佳途径。某垃圾箱上贴有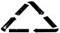
如右图所示标志,应向此垃圾箱中丢弃的垃圾是
A.废旧电池 B.厨余垃圾 C.危险废物
D.可回收物
4、 下列物质中,既有离子键,又有共价键的是
A.NaCl
B.Ca(OH)2
C.H2O
D.CH4
5、下列气态氢化物最稳定的的是
A. HCl B.HBr C.HI D.HF
6、 能用离子方程式“H++OH-===H2 O”表示的化学反应是
A、4HNO3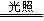 2H2O+4H2O↑+O2↑ B、NaOH+HCl=NaCl+H2O
C、Fe2O3+6HCl=2FeCl3+3H2O D、2H2+O2
2H2O+4H2O↑+O2↑ B、NaOH+HCl=NaCl+H2O
C、Fe2O3+6HCl=2FeCl3+3H2O D、2H2+O2 2H2O
7、 成人人体中缺某种微量元素时,会引起甲状腺肿大,该元素是
A.碘
B.氟 C.铁 D.锌
8、将一小块钠投入到NH4Cl溶液中,产生的气体是
A.氢气和NH3
B.只有氢气 C.只有NH3 D.氧气和氢气
9、 下列说法正确的是
A.等质量氢气和氯气所含分子数一样
2H2O
7、 成人人体中缺某种微量元素时,会引起甲状腺肿大,该元素是
A.碘
B.氟 C.铁 D.锌
8、将一小块钠投入到NH4Cl溶液中,产生的气体是
A.氢气和NH3
B.只有氢气 C.只有NH3 D.氧气和氢气
9、 下列说法正确的是
A.等质量氢气和氯气所含分子数一样
B.阿伏加德罗的精确值为6.02x1023mol-1
C.硫酸根的摩尔质量是96g/mol
D.二氧化碳的摩尔质量是44克
10、 日常生活中,常用到化学知识。下列说法不正确的是
A.某些铁盐溶于水生成的Fe(OH) 3胶体,可除去水中的悬浮颗粒等杂质
B.维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜
C.构成人体蛋白质的20多种氨基酸都能通过人体自身合成
D.可用燃烧的方法鉴别真丝围巾和合成纤维围巾
11、 下列物质互为同素异形体的是
A、612C和613C
B、金刚石和石墨
C、CH4和C2H6
D、CH3CH2CH2CH3和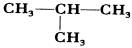 12、 下列关于能量转化的认识中,不正确的是
A.电解饱和食盐水时,电能转化为化学能
B.树木进行光合作用时,太阳能转化为化学能
C.汽油燃烧时,化学能转化为热能
D.电灯工作时,电能全部转化为光能
13、 右下图是某有机物的球棍模型,其中
12、 下列关于能量转化的认识中,不正确的是
A.电解饱和食盐水时,电能转化为化学能
B.树木进行光合作用时,太阳能转化为化学能
C.汽油燃烧时,化学能转化为热能
D.电灯工作时,电能全部转化为光能
13、 右下图是某有机物的球棍模型,其中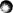 (代表氢原子,
(代表氢原子,
 代表碳原子,该有机物的名称是
代表碳原子,该有机物的名称是  A.乙烷[CH3CH3]
B.乙醇[CH3CH2OH] C.乙烯[CH2=CH2] D.乙酸[CH3COOH]
14、 暴露在空气中不易变质的是
A.钠 B.氧化钠 C.氯化钠 D.氢氧化钠
15、 随着科学技术的发展,新材料层出不穷。下列属于金属材料的是
A.生物陶瓷
B.钢化玻璃 C.钛合金
D.聚四氟乙烯
16、金属钠和纯水反应实验中,下列现象没有产生的是
A.产生气体
B.溶液充变红色
C.钠块熔化成银白色小球
D.银白色的小球浮在水面上
17、 下列各装置中,能构成原电池的是
A.乙烷[CH3CH3]
B.乙醇[CH3CH2OH] C.乙烯[CH2=CH2] D.乙酸[CH3COOH]
14、 暴露在空气中不易变质的是
A.钠 B.氧化钠 C.氯化钠 D.氢氧化钠
15、 随着科学技术的发展,新材料层出不穷。下列属于金属材料的是
A.生物陶瓷
B.钢化玻璃 C.钛合金
D.聚四氟乙烯
16、金属钠和纯水反应实验中,下列现象没有产生的是
A.产生气体
B.溶液充变红色
C.钠块熔化成银白色小球
D.银白色的小球浮在水面上
17、 下列各装置中,能构成原电池的是
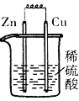
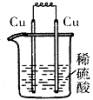
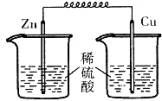 A B C D
A B C D
厦门市杏南中学高二文科化学月考试题
第II卷
22.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
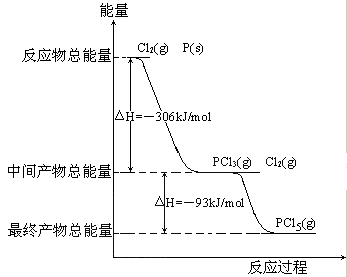
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1[分解率即分解量除起始量]等于_____ ____;。
(3) P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________。
21.氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436kJ·mol-1,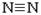 键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
18. 某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
|
实验 序号 |
 浓度 浓度时间 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min,C3 1.0 mol•L-1(填“ < ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率 (填“快”或“慢”),原因是 。
(3)如果2A (g) ≒ B(g) + D(g) 是一个放热反应,那么实验4与实 验1相比, 放出的热量多,理由是 。
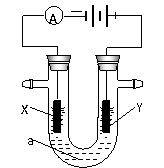 20电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
20电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
(3)若要在铁制品表面镀上一层银,则可选用 溶液为电解液,
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
17.完成下列表格的填写
|
电解对象 |
阳极反应式 |
阴极反应式 |
总反应式 |
|
氯化铜溶液 |
|
|
|
|
氢氧化钠溶液 |
|
|
|
|
盐酸 |
|
|
|
|
融熔氧化铝 |
|
|
|
|
硫酸钠溶液 |
|
|
|
16.(7分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是______________ ___________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是____________
___________________________________;所求中和热的数值会________(填“相等”
或“不相等”),理由是__________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com