
题目列表(包括答案和解析)
8、反应C(s)+H2O(g) 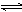 CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A、保持体积不变,加入CO气体 B、将C(s)粉碎成细小粉末
C、保持体积不变,充入氩气 D、降低反应体系温度
7.下列说法中正确的是
A.已知:2H2O(l)= 2H2(g)+O2(g);△H1>0
H2O(l)=H2(g)+1/2 O2(g);△H2>0 则△H1>△H2
B.在合成氨工业生产中,为提高氢气的转化率,可采取使用催化剂的措施
C.因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
D.热量可能自发地从低温物体传递到高温物体
6.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g) ==2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1
B.已知4P(红磷,s)== P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) == CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
5.已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H= Q1kJ/mol
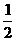 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=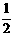 Na2SO4(aq)+H2O(1) △H= Q2kJ/mol
Na2SO4(aq)+H2O(1) △H= Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H= Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
4、下列说法或表示方法正确的是
A、反应物的总能量低于生成物的总能量时,该反应一定不能发生
B、强酸跟强碱反应放出的热量就是中和热
C、由石墨比金刚石稳定可知: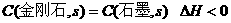
D、在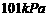 、
、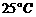 时,
时,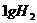 完全燃烧生成气态水,放出
完全燃烧生成气态水,放出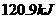 热量,则氢气的燃烧热为241.8
热量,则氢气的燃烧热为241.8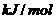
3.下列热化学方程式书写正确的是
A.2SO2+O2 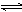 2SO3; △H=-196.6kJ/mol
2SO3; △H=-196.6kJ/mol
B.C(s)+O2(g)==CO2(g);△H=393.5kJ/mol
C.1/2H2(g)+1/2Cl2(g)==HCl(g);△H=-92.5kJ/mol
D.H+(aq)+OH-(aq)==H2O(l);△H=57.3kJ
2.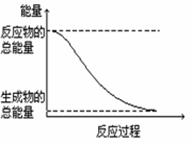 下列变化属于放热反应的是
下列变化属于放热反应的是
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时放出能量的化学反应
D.能量变化如右图所示的化学反应
1.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用反应物、产物中键能数据可判断对应反应的反应热
B.用沸点数据推测将一些液体混合物用分镏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率的快慢
D.用平衡时各组分的物质的量浓度可计算一定温度下反应的平衡常数
29.(10分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
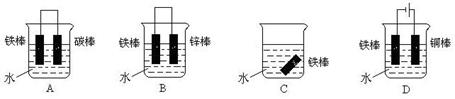
(1)下列哪个装置可防止铁棒被腐蚀_____________ 。
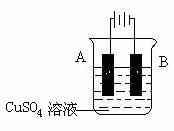 (2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如右:
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如右:
请回答:
①A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
②若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为51.2 g,则电镀时电路中通过的电子物质的量为_______。
福州市八县(市)协作校2010-2011学年第一学期半期联考
28.(10分)下表是50 mL稀硫酸与0.10 g某金属反应的实验数据:
|
实验 序号 |
金属 状态 |
c(H2SO4) /mol·L-1 |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||
|
1 |
丝 |
0.7 |
20 |
36 |
250 |
|
2 |
丝 |
0.8 |
20 |
35 |
200 |
|
3 |
粉末 |
0.8 |
20 |
35 |
25 |
|
4 |
丝 |
1.0 |
? |
35 |
125 |
|
5 |
丝 |
1.0 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响, 反应速率越快;
(2) 实验4中“?”处的温度分别是 ℃。
(3) 仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(4) 本实验中影响反应速率的其他因素还有 ,其实验序号是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com