
题目列表(包括答案和解析)
29. (1)_____ __、
___ __、
___ _。
(2) 有 。
(3) 是__ ________。
(4) 和
28.(1)是 (填编号)
(2)是 (填编号)
(3)是 (填编号)
(4)反应的离子方程式 。
27.结果偏高的有__ __ _。
26.(1)
(2) , ,
(3)ΔH= kJ·mol-1。
(4)K=
(5) , 。
30.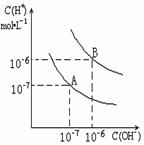 已知水在25℃和95℃时,其电离平衡曲线如右图所示:
已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为
(填“A”或“B”),请说明理由
(2)25时,将=9的NaOH溶液与=4的溶液混合,若所 得混合溶液的 =7,则NaOH溶液与溶液的体积比为
(3)95时,0.1mol/L的NaOH溶液的PH为
(4)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后,溶液呈中性,则混合前,该强酸的1与强碱的2 之间应满足的关系是
|
班级:
姓名:
考场:
考号:
座位号:___________ |
|
密
封 线 密 封 线 内 请 勿 答 题 密 封 线 |
新疆兵团二中2010-2011学年第一学期期中考试
化 学 答 题 卷 2010-11-9
(沉着、冷静、细心;注意卷面整洁,试卷自行保管好,考后讲评)
29.常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的三个平衡体系是_______、_________、_________。(用离子方程式表示)
(2)溶液中共有 种不同的粒子。
(3)物质的量之和为0.01mol的两种粒子是__________。
(4) 和 两种粒子数量之和比OH-多0.008mol
28.现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH 已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是 (填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 (填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是 (填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
27.取20.00 mL待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定,在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_____。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
26.联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g) 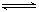 N2O4(g) ΔH=-57.20
KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是
N2O4(g) ΔH=-57.20
KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)已知在T℃,2L密闭容器中,加入4mol NO2(g),发现5分钟末反应达平衡时,放出的热量为57.20 KJ,则此时N2O4的体积分数为 ,在此时间内用N2O4表示的反应速率为 达平衡后,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
(3)25℃时,1.00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)== 3N2(g)+4H2O(l)的ΔH= kJ·mol-1。
(4)17℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时, c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。反应2NO2(g) 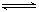 N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=
(5)T℃、1.01×105 Pa,已知K=1/3,在2L密闭容器中,加入10mol NO2(g) 和4mol N2O4(g),则平衡向生成 物质的方向移动,再次平衡时,NO2(g)的浓度是 。
25.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2 ,再加入CuO粉末调节pH为4-5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com