
题目列表(包括答案和解析)
11.下列溶液中有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +c(OH-) == c(H+) + c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
D.0.1mol·L-1的NaHA溶液,其pH=4,则有:c(HA- )>c(H+)>c(H2A)>c(A2- )
10.下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O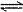 H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3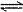 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O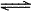 H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3 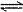 Ca2++CO32-
Ca2++CO32-
9.下列溶液加热蒸干后,能析出溶质固体本身的是
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4NO3
8.有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A.Y>Z>W>X B.Z>Y>W>X
C.W>Z>Y>X D.X>Y>Z>W
7. 某酸溶液中C(H+)=0.1mol·L-1,则该酸溶液的物质的量浓度
某酸溶液中C(H+)=0.1mol·L-1,则该酸溶液的物质的量浓度
A.一定等于0.1mol·L-1 B.一定大于0.1mol·L-1
C.一定小于0.1mol·L-1 D.无法确定
6.对于可逆反应A(g)+2B(g)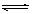 2C(g)(正反应吸热),下列图象中正确的是
2C(g)(正反应吸热),下列图象中正确的是
5.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法正确的是
A.反应达到平衡时,X的转化率为60%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.减小压强可使平衡向生成Z的方向移动
D.改变压强可以改变此反应的平衡常数
4.下列各组变化中,化学反应的热量变化前者小于后者的一组是
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)===2H2O(l) ΔH1
H2(g)+1/2O2(g)===H2O(l) ΔH2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A.①②③ B.②④ C.②③④ D.③④
3.一些盐的结晶水合物,在温度不太高时就有熔化现象,即熔溶于自身的洁净水中,又同时吸收热量。他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。现有几种盐的结晶水合物有关数据如下
|
|
① Na2S2O3·5H2O |
② CaCl2·6H2O |
③ Na2SO4·10H2O |
④Na2HPO4·10H2O |
|
熔点/℃ |
40-50 |
29.92 |
32.38 |
35.1 |
|
熔化热/kJ· mol-1 |
49.7 |
37.3 |
77 |
100.1 |
根据上述数据和实用性考虑,实际运用时常采用的物质应该是
A.① B.② C.③ D.④
2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A.该反应是吸热反应
B.该反应是非氧化还原反应
C.铁粉和硫粉在常温下难以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com