
题目列表(包括答案和解析)
1.下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
30.(15分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。YZ2分子中中心原子的价层电子对数为 。
(2)在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 ,向含有W2+的溶液中逐滴加入过量的氨水,现象为 ,相应的离子方程式为 、 。
(4)相同条件下XO2与YO2分子在水中溶解度较大是 ,理由是
。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
________________________________________________________________________________________________________________________________________。

29.(11分)下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
K^S*5U.C#O%
|
a |
|
|
|||||||||||||||
|
|
|
|
|
f |
y |
h |
i |
|
|||||||||
|
|
b |
|
e |
|
|
|
j |
|
|||||||||
|
c |
|
|
|
|
|
|
d |
[ |
d |
|
g |
|
l |
|
|
|
|
|
|
|
|
[ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请写出h元素的价电子排布图 ;
(2)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的杂化轨道类型是 , g2+可以与ya3 以 键形成 [g (ya3)4]2+离子;
(3)请写出上述元素d3+的核外电子排布式 ,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为
。
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
28.(9分)A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)D元素的名称为 ,E的电子排布式为 ;
(2)C、D、F的简单离子中,半径最小的是 (填离子符号);
(3)BA4的空间构型为 ,B、C两元素形成的非极性分子的结构式为
;
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
,可以相互反应生成O2的化学方程式为
;
(5)下列关于甲和乙的说法中,错误的是 (填序号)
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零
27.(13分)(1)以基态硅原子为例,如果电子排布式写作ls22s22p63s13p3则违反了
原理,如写作ls22s22p63s33p1则违反了 原理;
(2)已知H、C、Si三种元素的电负性依次为2.1、2.5、1.8,则CH4、SiH4中C、Si的化合价依次为 、 ;
(3)在我们现今使用的元素周期表中,元素种类最多的族是 族,共 种元素;元素种类最多的周期是第 周期,共 种元素;
(4)熔点: F2 Cl2(填“<”或“=”“或>”,下同),沸点:HF HCl,一定压强下HF和HCl的混合气体降温时 (填HF或HCl)先液化;
(5)前三周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素:
(用元素符号按原子序数由小到大排列)。
26.能用键能知识加以解释的是( )
A.稀有气体的化学性质很不活泼 B.HCl比HI稳定
C.干冰易升华 D.冰比水的密度小
II卷 (非选择题 共48分)
25.X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,下列判断错误的是
A.X的电负性大于Y的电负性
B.X的原子半径大于Y的原子半径
C.X的氧化性大于Y的氧化性
D.X的第一电离能大于Y的第一电离能
24.已知X、Y是主族元素,下表中I为电离能,单位是kJ/mol。下列判断错误的是
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
500 |
4600 |
6900 |
9500 |
|
Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1价 B.元素Y是ⅢA族的元素
 C.元素X与氯形成化合物时,化学式可能是XCl
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
23.下列说法正确的是
A.最外层电子排布为ns2的元素一定处于周期表IIA族
B.主族元素X、Y能形成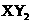 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5
C.亚硫酸的酸性比硫酸强
D.金属元素的电负性一定比非金属元素的电负性大
22.下列说法正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6
B.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,统称过渡金属元素
C.原子核外电子排布为1s1的原子与原子核外电子排布为1s22s1的原子的化学性质相似
D.所有的非金属元素都分布在p区
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com