
题目列表(包括答案和解析)
9.下列各组分子中都属于含极性键的非极性分子的是 ( )
A.CO2、H2S B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl

8.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.H2O C.SiCl4 D.PCl5
7. 碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为 ( )
A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
6.已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )
A.直线形 B.平面正方形 C.正四面体形 D.正八面体形
5.用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个。下列关于R的描述中正确的是( )
A.R的氧化物都能溶于水 B.R的最高价氧化物所对应的水化物都是H2RO3
C.R都是非金属元素 D.R的氧化物都能与NaOH溶液反应
4.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )
A.b=a-n-m B.离子半径Am+<Bn-
C.原子半径A<B D.A的原子序数比B大(m+n)
24.填空:(共12分)
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其氢化物的分子构型为________________,中心原子的杂化形式为________。
(2)用VSEPR 理论判断H3O+成键电子对数 孤电子对数 离子的形状
(3)B元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为________;
(4)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为__ ,其基态原子的电子排布式为 _ ___。位于周期表划分成5个区中的 区
(5)X、Y元素能形成XY2型化合物,XY中共有38个电子,若XY2为离子化合物,其化学式是 若XY2为共价化合物,其化学式是 或
23、 (5分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子。请回答:
(5分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子。请回答:
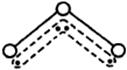
O3的分子结构
⑴ 题中非极性共价键是 键,特殊的化学键是 键。(填“σ”或“π”)
⑵ 下列物质的分子与O3分子的结构最相似的是 。
A.H2O B.CO2 C.SO2 D.BeCl2
⑶ 原子中没有跟其他原子共用的电子对叫孤对电子,那么O3分子有 对孤对电子。
(4) 下列有关说法中正确的是 。
A.臭氧和氧气互为同素异形体,它们在水中的溶解度相近
B.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
C.臭氧转化为氧气和氧气转化为臭氧均需吸收能量
D.向大气中排放氟氯代烃不能加快臭氧的分解
22.(5分)在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=A/n (K为A与n的比值)。请选编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____________性越强。
(2)当A一定时,K值越小,则元素的________性越强。
(3)当K=0,则该元素系_________元素, 当K=1时,则该元素系_________元素(除H外),当K<1时,则该元素系_________元素。
21.(12分) W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为 < (用分子式表示)。
(3)四种元素原子半径的大小为 > > > (填元素符号)
(4)四种元素的电负性由大到小的顺序为 。
(5)这四种元素形成化合物的化学式为离子化合物 ;(至少写4种)共价化合物 (写二种)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com